
Struttura, proprietà, usi del tetracloruro di carbonio (CCl4)
Il tetracloruro di carbonio è un liquido incolore, con un odore leggermente dolce, simile all'odore di etere e cloroformio. La sua formula chimica è CCl4, e costituisce un composto covalente e volatile, il cui vapore ha una densità maggiore dell'aria; non è un conduttore di elettricità né è infiammabile.
Si trova nell'atmosfera, nell'acqua del fiume, nel mare e nei sedimenti sulla superficie marina. Si ritiene che il tetracloruro di carbonio presente nelle alghe rosse sia sintetizzato dallo stesso organismo.
Nell'atmosfera è prodotto dalla reazione di cloro e metano. Il tetracloruro di carbonio prodotto industrialmente entra nell'oceano, principalmente attraverso l'interfaccia mare-aria. Il suo flusso atmosferico => oceanico è stato stimato in 1,4 x 1010 g / anno, equivalente al 30% del tetracloruro di carbonio totale nell'atmosfera.
Indice articolo
- 1 Caratteristiche principali
- 2 Struttura
- 3 Proprietà fisiche e chimiche
- 4 Usi
- 4.1 Produzione chimica
- 4.2 Produzione di refrigeranti
- 4.3 Soppressione del fuoco
- 4.4 Pulizia
- 4.5 Analisi chimiche
- 4.6 Spettroscopia infrarossa e risonanza magnetica nucleare
- 4.7 Solvente
- 4.8 Altri usi
- 5 Tossicità
- 5.1 Meccanismi epatotossici
- 5.2 Effetti tossici sul sistema nervoso centrale e renale
- 5.3 Effetti dell'esposizione nell'uomo
- 5.4 Interazioni tossiche
- 6 Interazioni intermolecolari
- 7 Riferimenti
Caratteristiche principali
Il tetracloruro di carbonio è prodotto industrialmente dalla clorurazione termica del metano, facendo reagire il metano con il cloro gassoso a una temperatura compresa tra 400ºC e 430ºC. Durante la reazione si genera un prodotto grezzo, con un sottoprodotto dell'acido cloridrico.
Inoltre è prodotto industrialmente con il metodo del disolfuro di carbonio. Il cloro e il disolfuro di carbonio vengono fatti reagire a una temperatura compresa tra 90 ° C e 100 ° C, utilizzando il ferro come catalizzatore. Quindi il prodotto grezzo viene sottoposto a frazionamento, neutralizzazione e distillazione.
Il CCl4 Ha avuto molteplici usi, tra gli altri: solvente per grassi, oli, vernici, ecc.; lavaggio a secco di indumenti; fumigazione di pesticidi, agricoli e fungicidi e produzione di nylon. Tuttavia, nonostante la sua grande utilità, il suo utilizzo è stato parzialmente scartato a causa dell'elevata tossicità che presenta..
Nell'uomo genera effetti tossici sulla pelle, sugli occhi e sulle vie respiratorie. Ma i suoi effetti più dannosi si verificano sul funzionamento del sistema nervoso centrale, del fegato e dei reni. Il danno renale è forse la principale causa di morte attribuita all'azione tossica del tetracloruro di carbonio.
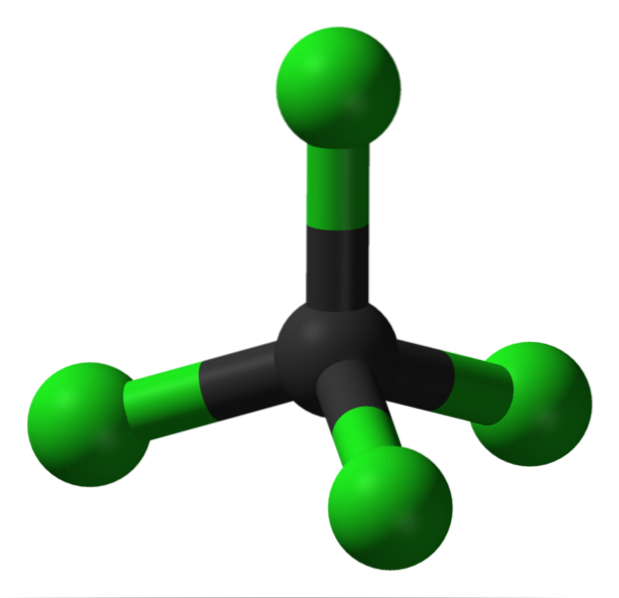
Struttura
Nell'immagine puoi vedere la struttura del tetracloruro di carbonio, che è di geometria tetraedrica. Si noti che gli atomi di Cl (le sfere verdi) sono orientati nello spazio attorno al carbonio (sfera nera) disegnando un tetraedro.
Allo stesso modo, va detto che poiché tutti i vertici del tetraedro sono identici, la struttura è simmetrica; cioè, non importa come viene ruotata la molecola CCl4, sarà sempre lo stesso. Quindi, dal momento che il tetraedro verde di CCl4 è simmetrico, risulta in assenza di un momento di dipolo permanente.
Perché? Perché sebbene i legami C-Cl siano di carattere polare a causa della maggiore elettronegatività di Cl rispetto a C, questi momenti si annullano vettoriale. Pertanto, è un composto organico clorurato apolare..
Il carbonio è completamente clorurato in CCl4, che è uguale a un'ossidazione elevata (il carbonio può formare un massimo di quattro legami con il cloro). Questo solvente non tende a perdere elettroni, è aprotico (non ha idrogeni) e rappresenta un piccolo mezzo di trasporto e stoccaggio del cloro..
Proprietà fisiche e chimiche
Formula
CCl4
Peso molecolare
153,81 g / mol.
Aspetto fisico
È un liquido incolore. Cristallizza sotto forma di cristalli monoclinici.
Odore
Ha il caratteristico odore presente in altri solventi clorurati. L'odore è aromatico e un po 'dolce, simile all'odore di tetracloroetilene e cloroformio.
Punto di ebollizione
170,1ºF (76,8 ° C) a 760 mmHg.
Punto di fusione
-9ºF (-23ºC).
Solubilità dell'acqua
È scarsamente solubile in acqua: 1,16 mg / mL a 25 ºC e 0,8 mg / mL a 20 ºC. Perché? Perché l'acqua, una molecola altamente polare, non "sente" affinità per il tetracloruro di carbonio, che è non polare..
Solubilità in solventi organici
A causa della simmetria della sua struttura molecolare, il tetracloruro di carbonio è un composto non polare. Pertanto, è miscibile con alcol, benzene, cloroformio, etere, disolfuro di carbonio, etere di petrolio e nafta. Allo stesso modo, è solubile in etanolo e acetone..
Densità
Allo stato liquido: 1,59 g / ml a 68 º F e 1,594 g / ml a 20 ºC.
Allo stato solido: 1,831 g / ml a -186 ºC e 1,809 g / ml a -80 ºC.
Stabilità
Generalmente inerte.
Azione corrosiva
Attacca alcune forme di plastica, gomme e rivestimenti.
punto di accensione
È considerato poco infiammabile, indicando che il punto di accensione è inferiore a 982 ºC.
Accensione automatica
982 ºC (1800 º F; 1255 K).
Densità del vapore
5.32 rispetto all'aria, preso come valore di riferimento pari a 1.
Pressione del vapore
91 mmHg a 68 ° F; 113 mmHg a 77ºF e 115 mmHg a 25ºC.
Decomposizione
In presenza di fuoco forma cloruro e fosgene, un composto altamente tossico. Allo stesso modo, nelle stesse condizioni si decompone in acido cloridrico e monossido di carbonio. In presenza di acqua ad alte temperature, può causare acido cloridrico.
Viscosità
2,03 x 10-3 Pa s
Soglia di odore
21,4 ppm.
Indice di rifrazione (ηD)
1.4607.
Applicazioni
Produzione chimica
-Interviene come agente clorante e / o solvente nella produzione di cloro organico. Allo stesso modo, interviene come monomero nella fabbricazione del nylon..
-Agisce come solvente nella produzione di gomma cementizia, sapone e insetticida.
-Viene utilizzato nella produzione del propellente clorofluorocarburo.
-Non avendo legami C-H, il tetracloruro di carbonio non subisce reazioni di radicali liberi, rendendolo un solvente utile per alogenazioni, sia da parte di un alogeno elementare che da parte di un reagente alogenante, come N-bromosuccinimide..
Produzione di refrigeranti
È stato utilizzato nella produzione di clorofluorocarburo, refrigerante R-11 e triclorofluorometano, refrigerante R-12. Questi refrigeranti distruggono lo strato di ozono, motivo per cui è stato raccomandato di cessarne l'uso, in conformità con le raccomandazioni del protocollo di Montreal..
Soppressione del fuoco
All'inizio del XX secolo, il tetracloruro di carbonio iniziò ad essere utilizzato come estintore, in base a una serie di proprietà del composto: è volatile; il suo vapore è più pesante dell'aria; non è un conduttore elettrico e non è molto infiammabile.
Quando il tetracloruro di carbonio viene riscaldato si trasforma in un vapore pesante che ricopre i prodotti della combustione, isolandoli dall'ossigeno presente nell'aria e provocando lo spegnimento del fuoco. È adatto per combattere gli incendi di petrolio e elettrodomestici.
Tuttavia, a temperature superiori a 500 ºC, il tetracloruro di carbonio può reagire con l'acqua, provocando il fosgene, un composto tossico, quindi è necessario prestare attenzione alla ventilazione durante l'uso. Inoltre, può reagire in modo esplosivo con il sodio metallico e il suo utilizzo negli incendi con la presenza di questo metallo dovrebbe essere evitato..
Pulizia
Il tetracloruro di carbonio è stato a lungo utilizzato nel lavaggio a secco di indumenti e altri materiali domestici. Inoltre, viene utilizzato come sgrassante industriale per metalli, ottimo per sciogliere grassi e oli.
Analisi chimica
Utilizzato per la rilevazione di boro, bromuro, cloruro, molibdeno, tungsteno, vanadio, fosforo e argento.
Spettroscopia infrarossa e risonanza magnetica nucleare
-Viene utilizzato come solvente nella spettroscopia infrarossa, poiché il tetracloruro di carbonio non ha un assorbimento significativo in bande> 1600 cm-1.
-Era usato come solvente nella risonanza magnetica nucleare, poiché non interferiva con la tecnica in quanto non aveva idrogeno (è aprotico). Ma a causa della sua tossicità e del suo basso potere solvente, il tetracloruro di carbonio è stato sostituito da solventi deuterati..
Solvente
La caratteristica di essere un composto non polare consente l'utilizzo del tetracloruro di carbonio come dissolvente per oli, grassi, lacche, vernici, cere di gomma e resine. Può anche sciogliere lo iodio.
Altri usi
-È un componente importante nelle lampade lava, poiché il tetracloruro di carbonio aggiunge peso alla cera a causa della sua densità..
-Utilizzato dai collezionisti di francobolli in quanto rivela filigrane sui francobolli senza causare danni.
-È stato utilizzato come agente pesticida e fungicida e nella fumigazione dei cereali per eliminare gli insetti.
-Nel processo di taglio dei metalli viene utilizzato come lubrificante.
-È stato utilizzato in medicina veterinaria come antielmintico nel trattamento della fasciolasi, causata da Fasciola hepatica negli ovini..
Tossicità
-Il tetracloruro di carbonio può essere assorbito attraverso le vie respiratorie, digestive, oculari e cutanee. L'ingestione e l'inalazione sono molto pericolose in quanto possono causare gravi danni a lungo termine al cervello, al fegato e ai reni..
-Il contatto con la pelle provoca irritazione e alla lunga può provocare dermatiti. Mentre il contatto con gli occhi provoca irritazione.
Meccanismi epatotossici
I principali meccanismi che producono danni al fegato sono lo stress ossidativo e l'alterazione dell'omeostasi del calcio.
Lo stress ossidativo è uno squilibrio tra la produzione di specie reattive dell'ossigeno e la capacità del corpo di generare un ambiente riducente, all'interno delle sue cellule, che controlla i processi ossidativi..
Lo squilibrio nel normale stato redox può provocare effetti tossici dovuti alla produzione di perossidi e radicali liberi che danneggiano tutti i componenti delle cellule..
Il tetracloruro di carbonio viene metabolizzato producendo radicali liberi: Cl3C. (radicale triclorometile) e Cl3COO. (radicale perossido di triclorometile). Questi radicali liberi producono la lipoperossidazione, che provoca danni al fegato e anche ai polmoni.
I radicali liberi causano anche la rottura della membrana plasmatica delle cellule del fegato. Ciò produce un aumento della concentrazione di calcio citosolico e una diminuzione del meccanismo intracellulare di sequestro del calcio..
L'aumento del calcio intracellulare attiva l'enzima fosfolipasi ADue che agisce sui fosfolipidi della membrana, aggravandone l'affettazione. Inoltre, c'è infiltrazione di neutrofili e danno epatocellulare. C'è una diminuzione della concentrazione cellulare di ATP e glutatione che causa l'inattivazione enzimatica e la morte cellulare.
Effetti tossici sul sistema renale e sul sistema nervoso centrale
Gli effetti tossici del tetracloruro di carbonio si manifestano nel sistema renale con una diminuzione della produzione di urina e l'accumulo di acqua nel corpo. Soprattutto nei polmoni e un aumento della concentrazione di scorie metaboliche nel sangue. Questo può causare la morte.
A livello del sistema nervoso centrale, vi è il coinvolgimento della conduzione assonale degli impulsi nervosi.
Effetti dell'esposizione nell'uomo
Breve durata
Irritazione agli occhi; effetti sul fegato, sui reni e sul sistema nervoso centrale, che possono portare alla perdita di coscienza.
Lunga durata
Dermatiti e possibile azione cancerogena.
Interazioni tossiche
Esiste un'associazione tra molti dei casi di avvelenamento da tetracloruro di carbonio e l'uso di alcol. L'eccessiva assunzione di alcol provoca danni al fegato, in alcuni casi causando cirrosi epatica.
È stato osservato che la tossicità del tetracloruro di carbonio aumenta con i barbiturici, poiché hanno alcuni effetti tossici simili..
Ad esempio, a livello renale, i barbiturici riducono l'escrezione di urina, questa azione dei barbiturici essendo simile all'effetto tossico del tetracloruro di carbonio sulla funzione renale..
Interazioni intermolecolari
Il CCl4 può essere considerato come un tetraedro verde. Come interagisci con gli altri?
Essendo una molecola apolare, senza momento di dipolo permanente, non può interagire tramite forze dipolo-dipolo. Per tenere insieme le loro molecole nel liquido, gli atomi di cloro (i vertici dei tetraedri) devono interagire in qualche modo tra loro; e lo fanno grazie alle forze di dispersione di Londra.
Le nuvole elettroniche di atomi di Cl si muovono, e per brevi istanti, generano aree ricche e povere di elettroni; cioè generano dipoli istantanei.
La zona ricca di elettroni δ fa polarizzare l'atomo di Cl di una molecola vicina: Clδ- δ+Cl. Quindi, due atomi di Cl possono essere tenuti insieme per un tempo limitato..
Ma poiché ci sono milioni di molecole CCl4, le interazioni diventano sufficientemente efficaci da formare un liquido in condizioni normali.
Inoltre, le quattro CI legate covalentemente a ciascuna C aumentano notevolmente il numero di queste interazioni; tanto che bolle a 76,8 ° C, un punto di ebollizione alto.
Il punto di ebollizione di CCl4 non può essere più alto perché i tetraedri sono relativamente piccoli rispetto ad altri composti apolari (come lo xilene, che bolle a 144 ° C).
Riferimenti
- Hardinger A. Steven. (2017). Glossario illustrato di chimica organica: tetracloruro di carbonio. Estratto da: chem.ucla.edu
- Tutti Siyavula. (s.f.). Forze intermolecolari e interatomiche. Estratto da: siyavula.com
- Carey F. A. (2006). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Wikipedia. (2018). Tetracloruro di carbonio. Estratto da: en.wikipedia.org
- PubChem. (2018). Tetracloruro di carbonio. Estratto da: pubchem.ncbi.nlm.nih.gov
- Libro chimico. (2017). Tetracloruro di carbonio. Estratto da: chemicalbook.com


Nessun utente ha ancora commentato questo articolo.