
Proprietà degli alogenuri alchilici, preparazione, esempi

Il alogenuri alchilici sono composti organici in cui un atomo di carbonio con ibridazione sp3 è legato in modo covalente ad un alogeno (F, Cl, Br, I). Da un'altra prospettiva, è conveniente, per semplificare, presumere che siano aloalcani; questi sono alcani a cui alcuni atomi di H sono stati sostituiti da atomi di alogeno.
Inoltre, come indica il nome, gli atomi di alogeno devono essere legati a gruppi alchilici, R, per essere considerati di questo tipo di alogenuro; sebbene, strutturalmente possono essere sostituiti o ramificati e hanno anelli aromatici, e rimangono ancora un alogenuro alchilico.
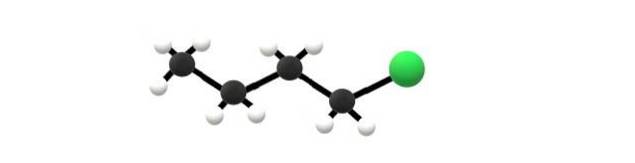
Sopra c'è la molecola di 1-clorobutano, che corrisponde a uno degli alogenuri alchilici più semplici. Si può vedere che tutti i suoi atomi di carbonio hanno legami singoli e hanno anche ibridazione sp3. Pertanto, la sfera verde, corrispondente all'atomo di Cl, è collegata a uno scheletro derivato dall'alcano butano.
Esempi ancora più semplici dell'1-clorobutano sono quelli derivati dal gas metano: l'idrocarburo più piccolo di tutti.
Dalla sua molecola di CH4 Gli atomi di H possono essere sostituiti, ad esempio, da iodio. Se viene sostituita una H, avremo CH3I (iodometano o ioduro di metile). Sostituendo due H, avremo CHDueioDue (diiodometano o ioduro di metilene). Poi e infine, le I sostituiscono tutte le H dando CHI3 (iodoform) e CI4 (tetraioduro di carbonio).
Gli alogenuri alchilici si caratterizzano per essere molto reattivi e, avendo gli atomi più elettronegativi nella tavola periodica, si intuisce che attraverso infiniti meccanismi esercitano un'influenza sulle matrici biologiche.
Indice articolo
- 1 Proprietà degli alogenuri alchilici
- 1.1 Punti di ebollizione e di fusione
- 1.2 Polarità
- 1.3 Potere solvente
- 2 Nomenclatura
- 2.1 Esempio
- 3 Ottenimento
- 3.1 Alogenazione con luce o radiazione ultravioletta
- 3.2 Aggiunta di idrocidi o alogeni agli alcheni
- 4 Reazioni
- 4.1 Sostituzione nucleofila
- 4.2 Smaltimento
- 4.3 Sintesi dei reagenti di Grignard
- 5 esempi
- 6 Usi
- 6.1 Solvente
- 6.2 Sintesi organica
- 6.3 Industria farmaceutica
- 6.4 Refrigeranti
- 7 Riferimenti
Proprietà degli alogenuri alchilici
Le proprietà di questa famiglia di composti dipendono dalle loro strutture molecolari. Tuttavia, se confrontati con quelli dei suoi alcani derivati, si possono osservare notevoli differenze dovute al semplice fatto di avere legami C-X (X = atomo di alogeno).
Cioè, i legami C-X sono responsabili di qualsiasi differenza o somiglianza tra uno o più alogenuri alchilici..
Per cominciare, i legami C-H sono quasi apolari, data la piccola differenza di elettronegatività tra C e H; d'altra parte, i legami C-X presentano un momento di dipolo permanente, dovuto al fatto che gli alogeni sono più elettronegativi del carbonio (soprattutto il fluoro).
D'altra parte, alcuni alogeni sono leggeri (F e Cl), mentre altri sono pesanti (Br e I). Le loro masse atomiche danno forma anche alle differenze all'interno dei legami C-X; ea sua volta, direttamente sulle proprietà dell'alogenuro.
Pertanto, l'aggiunta di alogeni a un idrocarburo equivale ad aumentare la sua polarità e massa molecolare; equivale a renderlo meno volatile (fino a un certo punto), meno infiammabile e aumentarne i punti di ebollizione o di fusione.
Punti di ebollizione e di fusione
Detto quanto sopra, le dimensioni e quindi il peso dei diversi alogeni sono riportati in ordine crescente:
F < Cl < Br < I
Pertanto, ci si può aspettare che gli alogenuri alchilici contenenti atomi di F siano più leggeri di quelli contenenti atomi di Br o I..
Ad esempio, si considerano alcuni alogenuri derivati dal metano:
CH3F < CH3Cl < CH3Br < CH3io
CHDueFDue < CHDueClDue < CHDueBrDue < CHDueioDue
E così via per gli altri prodotti derivati di un grado di alogenazione più elevato. Notare che l'ordine viene mantenuto: gli alogenuri di fluoro sono più leggeri degli alogenuri di iodio. Non solo, ma anche i loro punti di ebollizione e fusione obbediscono a quest'ordine; RF bolle a temperature inferiori a RI (R = CH3, per questo caso).
Allo stesso modo, tutti quei liquidi sono incolori, poiché gli elettroni non possono assorbire o rilasciare fotoni nei loro legami C-X per transitare altri livelli di energia. Tuttavia, man mano che diventano più pesanti, possono cristallizzare e visualizzare i colori (così come iodoform, CHI3).
Polarità
I legami C-X differiscono nella polarità, ma nell'ordine inverso come sopra:
C-F> C-Cl> C-Br> C-I
Pertanto, i legami C-F sono più polari dei legami C-I. Essendo più polari, gli alogenuri RF tendono ad interagire attraverso le forze dipolo-dipolo. Nel frattempo, negli alogenuri RBr o RI, i loro momenti di dipolo sono più deboli e le interazioni governate dalle forze di dispersione di Londra acquisiscono maggiore forza..
Potere solvente
Poiché gli alogenuri alchilici sono più polari degli alcani da cui derivano, aumentano la loro capacità di sciogliere un numero maggiore di composti organici. È per questo motivo che tendono ad essere solventi migliori; tuttavia, ciò non significa che possano soppiantare gli alcani in tutte le applicazioni.
Esistono criteri tecnici, economici, ecologici e prestazionali per preferire un solvente alogenato a un alcano.
Nomenclatura
Esistono due modi per denominare un alogenuro alchilico: con il suo nome comune o con il suo nome sistematico (IUPAC). I nomi comuni sono generalmente più convenienti da usare quando RX è semplice:
CHCl3
Cloroformio: nome comune
Tricloruro di metile o triclorometano: nome IUPAC.
Ma i nomi sistematici sono preferibili (e l'unica opzione), quando si hanno strutture ramificate. Ironia della sorte, i nomi comuni tornano utili quando le strutture sono troppo complicate (come quelle che si vedranno nell'ultima sezione).
Le regole per denominare un composto secondo il sistema IUPAC sono le stesse degli alcoli: si individua la catena principale, che è la più lunga o la più ramificata. Quindi, i carboni vengono elencati a partire dall'estremità più vicina ai sostituenti o ai rami, denominati in ordine alfabetico.
Esempio
Per illustrarlo, abbiamo il seguente esempio:
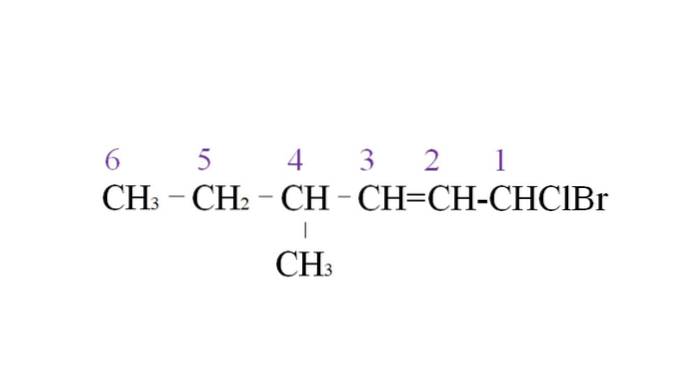
Il primo ramo è il gruppo metile in C-4; ma, poiché esiste un doppio legame, acquisisce maggiore priorità rispetto alla regola dichiarata. Per questo motivo, la catena più lunga inizia ad essere elencata da destra, guidata da un atomo di carbonio legato a due alogeni: Cl e Br.
Con l'enumerazione, i sostituenti sono denominati in ordine alfabetico:
1-bromo-1-cloro-4-metil-2-esene.
Ottenere
Per ottenere gli alogenuri alchilici, le molecole devono essere sottoposte ad un processo di alogenazione; cioè, incorporano atomi di alogeno nelle loro strutture, specialmente un atomo con un carbonio sp3.
Esistono due metodi per ottenerli o sintetizzarli: mediante radiazione ultravioletta attraverso un meccanismo di radicali liberi, oppure aggiungendo idrocidi o alogeni..
Alogenazione con luce o radiazione ultravioletta
Il primo, il meno appropriato e con le peggiori prestazioni, consiste nell'irradiare gli alcani con radiazioni ultraviolette (hv) in presenza di un alogeno. Ad esempio, vengono mostrate le equazioni per la clorazione del metano:
CH4 + ClDue => CH3Cl + HCl (sotto la luce UV)
CH3Cl + ClDue => CHDueClDue + HCl
CHDueClDue + ClDue => CHCl3 + HCl
CHCl3 + ClDue => CCl4 + HCl
I quattro composti (CH3Cl, CHDueClDue, CHCl3 e CCl4) si formano, e quindi si ha una miscela, che può essere sottoposta a distillazione frazionata. Tuttavia, questo metodo non è pratico e si preferisce il ricorso a sintesi organiche..
Un altro esempio è la bromurazione dell'n-esano:
CH3CHDueCHDueCHDueCHDueCH3 + BrDue => CH3(Br) CHCHDueCHDueCHDueCH3 + HBr
Ancora una volta, in questa reazione, la luce o la radiazione ultravioletta viene utilizzata per promuovere la formazione di radicali liberi. Il bromo, poiché è un liquido rosso intenso, si scolorisce quando reagisce, osservando così un cambiamento di colore da rosso a incolore quando si forma 2-bromoesano..
Aggiunta di idrocidi o alogeni agli alcheni
Il secondo metodo per ottenere alogenuri alchilici consiste nel trattare alcoli (ROH) o alcheni (RDueC = CRDue) con idracidi. Gli idracidi hanno la formula generale HX (HF, HCl, HBr e HI). Verrà mostrato un esempio utilizzando l'etanolo per ciascuno di essi:
CH3CHDueOH + HF => CH3CHDueF + HDueO
CH3CHDueOH + HCl => CH3CHDueCl + HDueO
CH3CHDueOH + HBr => CH3CHDueBr + HDueO
CH3CHDueOH + HI => CH3CHDueI + HDueO
Allo stesso modo, gli alcheni possono aggiungere molecole HX ai loro doppi legami, formando alogenuri alchilici secondari..
CHDue= CH-CH3 + HBr => BrCHDue-CHDue-CH3 + CH3-CHBr-CH3
Il prodotto BrCHDue-CHDue-CH3 è 1-bromopropano e CH3-CHBr-CH3 2-bromopropano. Il secondo è il prodotto di maggioranza perché è il più stabile, mentre il primo è prodotto in misura minore perché è più instabile. Questo perché il CH3CHBrCH3 è un alogenuro alchilico secondario.
Molto simile si verifica quando ciò che viene aggiunto all'alchene è una molecola di XDue:
CHDue= CH-CH3 + BrDue => BrCHDue-CHBr-CH3
Tuttavia, si ottiene un alogenuro alchilico con due atomi di bromo legati ad atomi di carbonio adiacenti; alogenuro alchilico vicinale. Se invece avessi i due bromo attaccati allo stesso carbonio, avresti un alogenuro alchilico geminale, come il seguente:
BrDueCH-CHDue-CH3
Reazioni
Sostituzione nucleofila
Le reattività degli alogenuri alchilici si basano sulla fragilità o forza del legame C-X. Più pesante è l'alogeno, più debole è il legame e quindi più facilmente si romperà. In una reazione chimica i legami si rompono e se ne formano di nuovi; I legami C-X vengono rotti, per formare un legame C-G (G = nuovo gruppo).
In termini più appropriati, X agisce come un gruppo uscente e G come un gruppo entrante in una reazione di sostituzione nucleofila. Perché si verifica questa reazione? Perché X, essendo più elettronegativo del carbonio, "ruba" la densità elettronica, lasciandolo un deficit di elettroni che si traduce in una carica parziale positiva:
Cδ+-Xδ-
Se una specie negativa (: G-) o neutro con una coppia di elettroni disponibile (: G), in grado di formare un legame C-G più stabile, X finirà per essere sostituito da G. Quanto sopra può essere rappresentato dalla seguente equazione chimica:
RX +: G- => RG + X-
Più debole è il legame C-X o R-X, maggiore è la sua reattività o tendenza a essere sostituita dal agente nucleofilo (o nucleofilo) G; cioè gli amanti dei nuclei o delle cariche positive.
Esempi
Di seguito è mostrata una serie di equazioni generali per le sostituzioni nucleofile che possono subire gli alogenuri alchilici:
RX + OH- => ROH + X- (Alcoli)
+ O'- => ROR' (Eteri, sintesi di Williamson)
+ io- => RI (ioduri alchilici)
+ CN- => RCN (nitrili)
+ R'COO- => RCOOR '(Esteri)
+ NH3 => RNHDue (Ammine)
+ P (C6H5)3 => RP (C6H5)3+ X- (Sali di fosfonio)
+ SH- => RSH (tioli)
Da questi esempi si può già sospettare quanto siano preziosi gli alogenuri alchilici per le sintesi organiche. Una delle tante sostituzioni che restava da citare è quella della reazione di Friedel Crafts, usata per "affittare" anelli aromatici:
RX + ArH + AlCl3 => ArR
In questa reazione, una H dell'anello aromatico viene sostituita da un gruppo R dell'RX.
Eliminazione
Gli alogenuri alchilici possono rilasciare molecole HX attraverso una reazione di eliminazione; in particolare, una deidroalogenazione:
RDueCH-CXRDue + Oh- => RDueC = CRDue + HX
Si dice che la deidroalogenazione avvenga perché sia una H che una X si perdono nella stessa molecola HX.
Sintesi dei reagenti di Grignard
Gli alogenuri alchilici possono reagire con alcuni metalli per formare il reagente di Grignard, utilizzato per aggiungere gruppi R ad altre molecole. L'equazione generale per la sua sintesi è la seguente:
RX + Mg => RMgX
Esempi
Vari esempi di alogenuri alchilici sono già stati menzionati in tutte le sezioni. Alcuni altri, semplici, sono:
-Cloruro di etile, CH3CHDueCl
-Fluoruro di isopropile, (CH3)DueCHDueF
-2-metil-3-cloropentano, CH3-CH (CH3) -CHCl-CHDueCH3
-ioduro di sec-butile, CH3CHDueCHDueI-CH3
-3-bromo-6-iodoeptano, CH3-CHDue-CHBr-CHDue-CHDue-CHDueio
-3,4-dibromo-1-pentene, CH3-CHBr-CHBr-CH = CHDue
Applicazioni
Solvente
Nelle sezioni precedenti è stata menzionata la capacità solvente degli alogenuri alchilici. L'industria ha approfittato di questa proprietà per usarli come detergenti, sia per materiali tessili, componenti elettronici o per rimuovere le macchie di vernice..
Allo stesso modo, vengono utilizzati come solventi per vernici, o campioni organici o grassi per innumerevoli tipi di test analitici..
Sintesi organica
Gli alogenuri alchilici sono molto utili per "alchilare" gli anelli aromatici, mentre servono come fonte di partenza per la sintesi di virtualmente tutte le altre famiglie di composti organici. Sinteticamente, RX è considerato una fonte di gruppi o catene R, che può essere desiderato per l'incorporazione in composti altamente aromatici..
Industria farmaceutica
Si è detto all'inizio che gli atomi di alogeno interagiscono con le matrici biologiche, così che nei nostri organismi non possono passare inosservati senza generare un cambiamento, positivo o negativo. Se un farmaco esercita un effetto positivo sul corpo, avendo un atomo di alogeno, questo effetto può o non può essere aumentato.
Quindi, se X è direttamente legato a un carbonio ibridizzato sp3, avrà un alogenuro alchilico e non un derivato alogenato. Alcuni di tali alogenuri sono mostrati di seguito nella seguente serie di immagini:
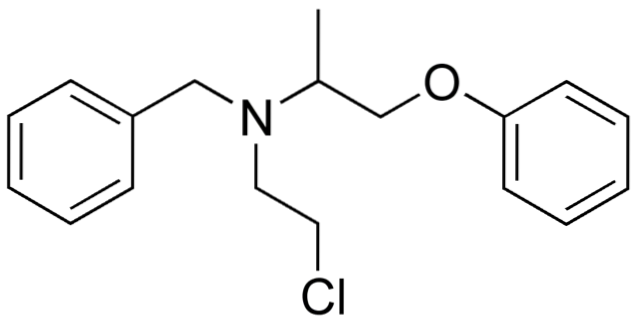
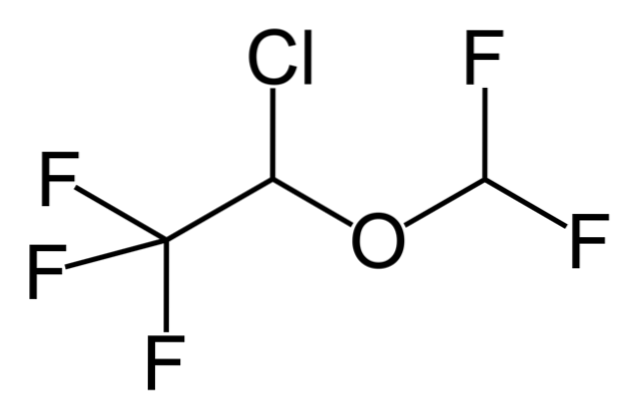

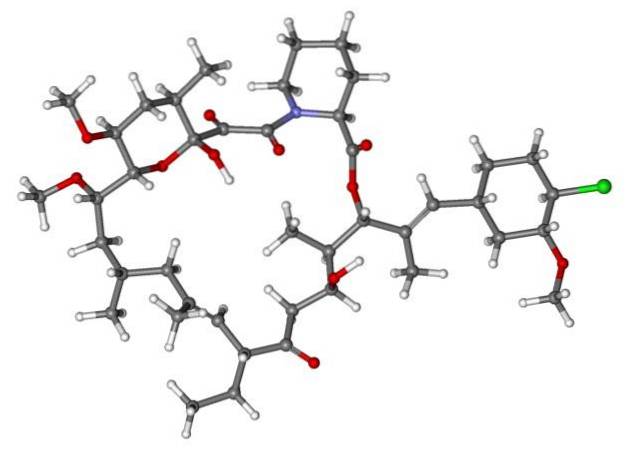

Si noti che in questi cinque farmaci è presente almeno un legame di tipo CHDue-X o CH-X; cioè, l'alogeno è attaccato a un carbonio sp3.
Refrigeranti
Il famoso refrigerante Freon-12 (CHCIFDue), come altri fluoroalcani o idrofluorocarburi, hanno sostituito i gas di ammoniaca e i clorofluorocarburi (CFC) in questa funzione perché, sebbene siano sostanze non volatili o tossiche, distruggono lo strato di ozono; mentre il freon-12, essendo più reattivo, viene distrutto prima di raggiungere tali altitudini.
Riferimenti
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Clark Jim. (2016, 14 luglio). Usi di alogenuri alchilici. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- Gál, B., Bucher, C. e Burns, N. Z. (2016). Alogenuri alchilici chirali: motivi inesplorati in medicina. Droghe marine, 14 (11), 206. doi: 10.3390 / md14110206
- Alogenuri alchilici. Estratto da: chemed.chem.purdue.edu
- Patkar Prachi. (16 luglio 2017). Tutto sugli alogenuri alchilici: proprietà, usi e molto altro ancora. La scienza ha colpito. Estratto da: sciencestruck.com
- R. Ship. (2016). Alogenuri alchilici. Estratto da: hyperphysics.phy-astr.gsu.edu
- Guida didattica per il Capitolo 9 - Alogenuri alchilici I. Estratto da: cactus.dixie.edu
- Q.A. Eduardo Vega Barrios. (s.f.). Alogenuri alchilici: proprietà, usi e applicazioni. [PDF. Recupero da: cvonline.uaeh.edu.mx



Nessun utente ha ancora commentato questo articolo.