
Proprietà, struttura, produzione, usi dell'etere etilico
Il etere etilico, noto anche come etere dietilico, è un composto organico la cui formula chimica è C4H10O. Si caratterizza per essere un liquido incolore e volatile, quindi le sue bottiglie devono essere tenute chiuse il più strettamente possibile.
Questo etere è classificato come un membro degli eteri dialchilici; cioè hanno la formula ROR ', dove R e R' rappresentano diversi segmenti di carbonio. E come descritto dal suo secondo nome, etere dietilico, sono due radicali etilici che si legano all'atomo di ossigeno.

L'etere etilico era inizialmente usato come anestetico generale, introdotto nel 1846 da William Thomas Green Morton. Tuttavia, a causa della sua infiammabilità, il suo utilizzo è stato scartato, sostituendolo con altri anestetici meno pericolosi..
Questo composto è stato utilizzato anche per stimare il tempo di circolazione sanguigna, durante la valutazione dello stato cardiovascolare dei pazienti..
All'interno del corpo, l'etere dietilico può essere trasformato in anidride carbonica e metaboliti; questi ultimi finiscono per essere escreti nelle urine. Tuttavia, la maggior parte dell'etere somministrato viene esalato nei polmoni, senza subire alcuna modifica..
D'altra parte, è usato come solvente per saponi, oli, profumi, alcaloidi e gomme..
Indice articolo
- 1 Struttura dell'etere etilico
- 1.1 Forze intermolecolari
- 2 Proprietà fisiche e chimiche
- 2.1 Altri nomi
- 2.2 Formula molecolare
- 2.3 Peso molecolare
- 2.4 Aspetto fisico
- 2.5 Odore
- 2.6 Aroma
- 2.7 Punto di ebollizione
- 2.8 Punto di fusione
- 2.9 Punto di infiammabilità
- 2.10 Solubilità in acqua
- 2.11 Solubilità in altri liquidi
- 2.12 Densità
- 2.13 Densità del vapore
- 2.14 Pressione di vapore
- 2.15 Stabilità
- 2.16 Autoaccensione
- 2.17 Decomposizione
- 2.18 Viscosità
- 2.19 Calore di combustione
- 2.20 Calore di vaporizzazione
- 2.21 Tensione superficiale
- 2.22 Potenziale di ionizzazione
- 2.23 Soglia di odore
- 2.24 Indice di rifrazione
- 3 Ottenimento
- 3.1 Da alcol etilico
- 3.2 Da etilene
- 4 Tossicità
- 5 Usi
- 5.1 Solvente organico
- 5.2 Anestesia generale
- 5.3 Spirito di Ether
- 5.4 Valutazione della circolazione sanguigna
- 5.5 Laboratori didattici
- 6 Riferimenti
Struttura dell'etere etilico
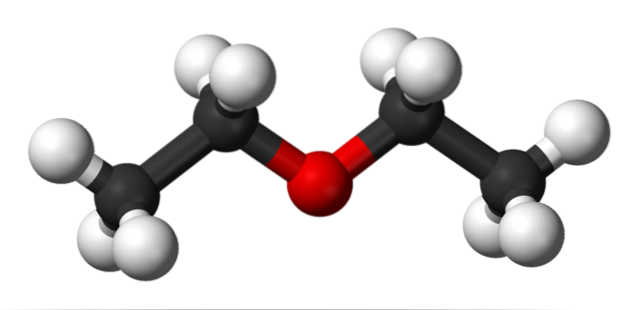
Nell'immagine in alto, c'è una rappresentazione con un modello di sfere e barre della struttura molecolare dell'etere etilico..
Come si può vedere, la sfera rossa, corrispondente all'atomo di ossigeno, ha due gruppi etilici legati su entrambi i lati. Tutti i collegamenti sono semplici, flessibili e ruotano liberamente attorno agli assi σ.
Queste rotazioni danno origine a stereoisomeri noti come conformeri; che più degli isomeri, sono stati spaziali alternativi. La struttura dell'immagine corrisponde esattamente all'anticonformer, in cui tutti i suoi gruppi di atomi sono sfalsati (separati l'uno dall'altro).
Quale sarebbe l'altro conformer? Quello eclissato, e sebbene la sua immagine non sia disponibile, è sufficiente visualizzarlo a forma di U. Alle estremità superiori dell'U, i gruppi metilici, -CH3, che subirebbe repulsioni steriche (collidere nello spazio).
Pertanto, ci si aspetta che la molecola CH3CHDueOCHDueCH3 adottare anti shaping la maggior parte del tempo.
Forze intermolecolari
Da quali forze intermolecolari sono governate le molecole di etere etilico nella fase liquida? Sono mantenuti nel liquido principalmente grazie alle forze di dispersione, poiché al loro momento di dipolo (1.5D) manca una regione sufficientemente carente nella densità elettronica (δ +)
Questo perché nessun atomo di carbonio nei gruppi etilici cede troppa densità elettronica all'atomo di ossigeno. Quanto sopra è evidente con la mappa del potenziale elettrostatico dell'etere etilico a portata di mano (immagine in basso). Notare l'assenza di una regione blu.
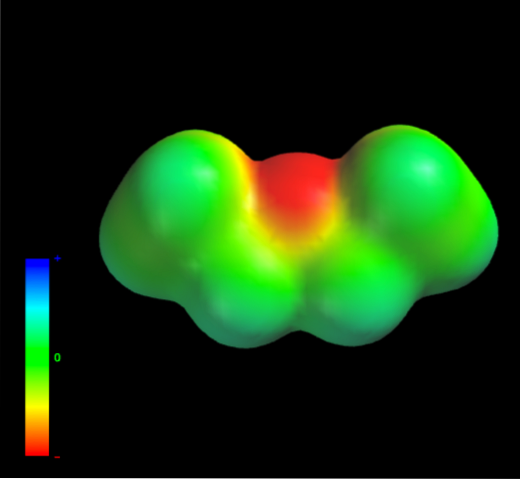
Anche l'ossigeno non può formare legami idrogeno, perché non ci sono legami O-H disponibili nella struttura molecolare. Pertanto, sono i dipoli istantanei e la loro massa molecolare che favoriscono le loro forze di dispersione..
Nonostante ciò, è altamente solubile in acqua. Perché? Perché il suo atomo di ossigeno, con una densità elettronica più elevata, può accettare legami idrogeno da una molecola d'acqua:
(CH3CHDue)DueOδ- - δ+H-OH
Queste interazioni sono responsabili della dissoluzione di 6,04 g di questo etere in 100 ml di acqua.
Proprietà fisiche e chimiche
Altri nomi
-Etere dietilico
-Etossietano
-Ossido di etile
Formula molecolare
C4H10O o (CDueH5)DueO.
Peso molecolare
74,14 g / mol.
Aspetto fisico
Liquido incolore.
Odore
Dolce e piccante.
Gusto
Bruciante e dolce.
Punto di ebollizione
94,3 ºF (34,6 ºC) a 760 mmHg.
Punto di fusione
--116,3 ° C (177,3 ° F). Cristalli stabili.
punto di accensione
-49ºF (contenitore chiuso).
Solubilità dell'acqua
6,04 g / 100 ml a 25 ºC.
Solubilità in altri liquidi
Miscibile con alcoli alifatici a catena corta, benzene, cloroformio, etere di petrolio, solvente grasso, molti oli e acido cloridrico concentrato.
Solubile in acetone e molto solubile in etanolo. È anche solubile in nafta, benzene e oli.
Densità
0,714 mg / mL a 68 ªF (20 ºC).
Densità del vapore
2,55 (in relazione all'aria prelevata con densità 1).
Pressione del vapore
442 mmHg a 68ºF. 538 mmHg a 25 ° C. 58,6 kPa a 20 ºC.
Stabilità
Viene lentamente ossidato dall'azione dell'aria, dell'umidità e della luce con la formazione di perossidi.
La formazione di perossidi può avvenire in contenitori di etere che sono stati aperti e che rimangono in deposito per più di sei mesi. I perossidi possono essere fatti esplodere per attrito, impatto o riscaldamento.
Evitare il contatto con: zinco, alogeni, alogenuri non metallici, agenti ossidanti forti, cloruro di cromile, oli di tementina, nitrati metallici e cloruri.
Accensione automatica
356 ºF (180 ºC).
Decomposizione
Quando riscaldato si decompone emettendo fumo acre e irritante.
Viscosità
0,2448 cPoise a 20 ºC.
Calore di combustione
8.807 Kcal / g.
Calore di vaporizzazione
89,8 cal / ga 30 ºC.
Tensione superficiale
17,06 dine / cm a 20 ° C.
Potenziale di ionizzazione
9.53 eV.
Soglia di odore
0,83 ppm (la purezza non è data).
Indice di rifrazione
1.355 a 15 ºC.
Ottenere
Dall'alcol etilico
L'etere etilico può essere ottenuto dall'alcool etilico, in presenza di acido solforico come catalizzatore. L'acido solforico in un mezzo acquoso si dissocia producendo lo ione idronio, H.3O+.
L'alcol etilico anidro scorre attraverso la soluzione di acido solforico, riscaldata tra 130 ° C e 140 ° C, producendo la protonazione delle molecole di alcol etilico. Successivamente, un'altra molecola di alcol etilico non protonato reagisce con la molecola protonata.
Quando ciò accade, l'attacco nucleofilo della seconda molecola di alcol etilico favorisce il rilascio di acqua dalla prima molecola (quella protonata); di conseguenza, un etere etilico protonato (CH3CHDueOHCHDueCH3), con ossigeno caricato parzialmente positivo.
Tuttavia, questo metodo di sintesi perde efficienza perché l'acido solforico viene diluito gradualmente con l'acqua prodotta nel processo (prodotto della disidratazione dell'alcool etilico)..
La temperatura di reazione è critica. A temperature inferiori a 130ºC, la reazione è lenta e l'alcol etilico verrà distillato per la maggior parte..
Al di sopra di 150 ºC, l'acido solforico provoca la formazione di etilene (il doppio legame alchene), invece di combinarsi con alcol etilico per formare etere etilico.
Dall'etilene
Nel processo inverso, cioè l'idratazione dell'etilene nella fase vapore, l'etere etilico può essere formato come sottoprodotto oltre all'alcol etilico. In effetti, questa via sintetica produce la maggior parte di questo composto organico..
Questo processo utilizza catalizzatori di acido fosforico attaccati a un supporto solido, che può essere regolato per produrre più etere..
La disidratazione in fase vapore dell'etanolo in presenza di catalizzatori di allumina può dare una resa del 95% nella produzione di etere etilico..
Tossicità
Può causare irritazione alla pelle e agli occhi per contatto. Il contatto con la pelle può provocare secchezza e screpolature. L'etere di solito non penetra nella pelle, poiché evapora rapidamente.
L'irritazione oculare causata dall'etere è generalmente lieve e, in caso di grave irritazione, il danno è generalmente reversibile.
La sua ingestione produce effetti narcotici e irritazione allo stomaco. Una forte ingestione può causare danni ai reni.
L'inalazione di etere può causare irritazione al naso e alla gola. In caso di inalazione di etere, può verificarsi quanto segue: sonnolenza, eccitazione, vertigini, vomito, respirazione irregolare e aumento della salivazione..
Un'elevata esposizione può causare perdita di coscienza e persino la morte.
L'OSHA stabilisce un limite di esposizione professionale per via aerea di 800 ppm in media su un turno di 8 ore..
Livelli di irritazione oculare: 100 ppm (umano). Livelli di irritazione oculare: 1200 mg / m3 (400 ppm).
Applicazioni
Solvente organico
È un solvente organico che viene utilizzato per sciogliere il bromo, lo iodio e altri alogeni; la maggior parte dei lipidi (grassi), resine, gomme pure, alcuni alcaloidi, gomme, profumi, acetato di cellulosa, nitrato di cellulosa, idrocarburi e coloranti.
Inoltre, viene utilizzato nell'estrazione di principi attivi da tessuti animali e vegetali, perché ha una densità inferiore all'acqua e galleggia su di essa, lasciando le sostanze desiderate disciolte nell'etere..
Anestesia generale
È stato utilizzato come anestetico generale dal 1840, in sostituzione del cloroformio in quanto ha un vantaggio terapeutico. Tuttavia, è una sostanza infiammabile e pertanto incontra gravi difficoltà nel suo utilizzo in ambienti clinici..
Inoltre, produce alcuni effetti collaterali postoperatori indesiderati come nausea e vomito nei pazienti..
Per questi motivi è stato scartato l'uso dell'etere come anestetico generale, sostituendolo con altri anestetici come l'alotano..
Ether Spirit
L'etere miscelato con l'etanolo è stato utilizzato per formare la soluzione chiamata spirito di etere, utilizzato nel trattamento della flatulenza gastrica e delle forme più lievi di gastralgia..
Valutazione della circolazione sanguigna
L'etere è stato utilizzato per valutare la circolazione sanguigna tra un braccio e i polmoni. L'etere viene iniettato in un braccio, portando il sangue all'atrio destro, quindi al ventricolo destro e da lì ai polmoni..
Il tempo che intercorre dall'iniezione dell'etere, fino alla cattura dell'odore dell'etere nell'aria espirata, è di circa 4 a 6 s.
Laboratori didattici
L'etere è usato nei laboratori didattici in molti esperimenti; per esempio, nella dimostrazione delle leggi genetiche di Mendel.
L'etere viene utilizzato per cullare le mosche del genere Drosophila e consentire i necessari incroci tra loro, mettendo così in evidenza le leggi della genetica
Riferimenti
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10th edizione.). Wiley plus.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Il Sevier. (2018). Etere dietilico. Science Direct. Estratto da: sciencedirect.com
- The Editors of Encyclopaedia Britannica. (2018). Etere etilico. ncyclopædia Britannica. Estratto da: britannica.com
- PubChem (2018). Etere. Estratto da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Etere dietilico. Estratto da: en.wikipedia.org
- Scheda di sicurezza XI: etere etilico. [PDF]. Estratto da: quimica.unam.mx



Nessun utente ha ancora commentato questo articolo.