
A cosa serve la tavola periodica? 7 Usi importanti

Il tavola periodica Serve a mostrare le relazioni tra i diversi elementi; Può anche essere utilizzato per prevedere le proprietà di nuovi elementi ancora scoperti o non ancora sintetizzati..
Fornisce informazioni e dati su gruppi, elementi, massa atomica, energia di ionizzazione, configurazione elettronica, numero atomico, elettronegatività e stati di ossidazione. La tavola periodica fornisce anche un utile quadro per analizzare il comportamento chimico; È ampiamente utilizzato nell'area della chimica e in molte altre scienze.
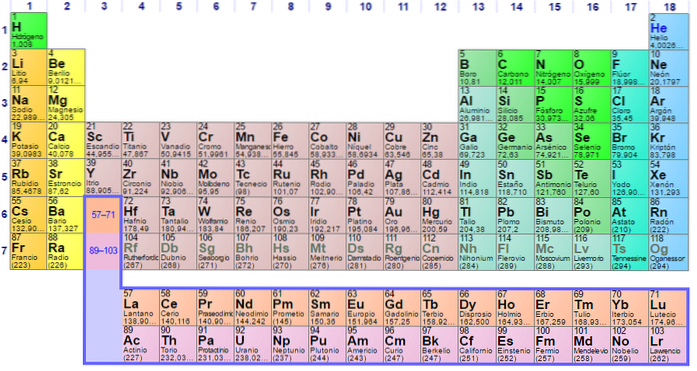
Fu costruito nel 1869 dallo scienziato russo Dmitri Ivanovich Mendeleev per visualizzare le diverse relazioni tra i vari elementi chimici.
La tavola periodica è ordinata in base al numero atomico, alle configurazioni elettroniche e alle proprietà chimiche ricorrenti. È anche ordinato in modo che gli elementi con comportamenti simili siano nella stessa colonna.
La tabella ha quattro blocchi rettangolari con proprietà chimiche simili. Generalmente, gli elementi situati sul lato sinistro di una riga sono metalli e i non metalli si trovano a destra.
Gli elementi si trovano sulla tavola periodica in base alla loro struttura atomica. Ogni riga e ogni colonna hanno caratteristiche speciali.
Tutte le righe della tabella vengono lette da sinistra a destra e ogni riga viene definita punto. Ogni colonna della tabella è chiamata gruppo. Ogni gruppo nella tabella ha lo stesso numero di elettroni.
È facile trovare il numero di elettroni nel guscio esterno di ogni elemento nella tabella. Il gruppo uno ha un elettrone, il gruppo due ne ha due e così via.
Una buona tavola periodica è un ottimo strumento per la risoluzione dei problemi in chimica. Le tavole periodiche possono essere trovate sul web o possono essere stampate.
Usi della tavola periodica a cosa serve?
Conosci il simbolo dell'elemento chimico
I simboli sono una scorciatoia per il nome dell'oggetto. In molti casi, l'abbreviazione deriva dal nome latino originale.
Ogni simbolo ha una o due lettere come abbreviazione. Di solito, il simbolo è un'abbreviazione del nome dell'elemento ma alcuni simboli si riferiscono ai vecchi nomi degli elementi.
Un esempio di questo caso è l'argento; il suo simbolo è Ag, che si riferisce al suo vecchio nome che era argentum.
Conosci il numero atomico dell'elemento
Questo è il numero di protoni contenuti in un atomo di questo elemento. Il numero di protoni è il fattore decisivo quando si tratta di distinguere un elemento da un altro. La variazione del numero di elettroni o neutroni non cambia il tipo di elemento.
Il cambiamento del numero di elettroni produce ioni, mentre i cambiamenti nel numero di neutroni producono isotopi. La tavola periodica moderna è disposta in ordine crescente di numero atomico.
Identifica il significato dei periodi e dei gruppi della tavola periodica
Le righe orizzontali sono chiamate periodi. Ogni periodo indica il livello più alto di energia che ciascuno degli elettroni di quell'elemento occupa nel suo stato di base..
Le colonne verticali sono chiamate gruppi. Ogni elemento in un gruppo ha lo stesso numero di elettroni di valenza e tipicamente si comportano in modo simile quando sono correlati ad altri elementi..
Le ultime due righe, i lantanidi e gli attinidi, appartengono al gruppo 3B e sono elencate separatamente..
Conosci il nome dell'elemento
Molte tavole periodiche includono anche il nome completo dell'articolo. Questo è utile quando si tratta di conoscere un elemento poiché non è sempre possibile ricordare i simboli di tutti gli elementi.
Acquisire familiarità con la massa atomica dell'elemento in unità di massa atomica
Questo numero si riferisce alla massa pesante media degli isotopi di un elemento chimico. La tavola periodica originale di Mendeleev era organizzata in modo che gli elementi fossero visualizzati in ordine crescente di massa o peso atomico..
Identifica i tipi di elementi
Molte tavole periodiche identificano diversi tipi di elementi utilizzando colori diversi per diversi tipi di elementi.
Questi tipi includono metalli alcalini, metalli di base, metalli di transizione, non metalli, gas nobili, allogeni, terre alcaline, semimetalli, attinidi e lantanidi..
Mostra le diverse tendenze (periodicità)
La tavola periodica è organizzata per mostrare i diversi tipi di trend (periodicità). Fra loro:
- Il raggio atomico, che è la metà della distanza tra i centri di due atomi che si toccano a malapena:
- Aumenta man mano che ci si sposta dall'alto verso il basso della tavola periodica.
- Scende mentre si sposta da sinistra a destra attraverso la tavola periodica.
- Energia di ionizzazione, che è l'energia richiesta per rimuovere un elettrone dall'atomo.
- Scende mentre si sposta su e giù per la tavola periodica.
- Aumenta man mano che ci si sposta da sinistra a destra sulla tavola periodica.
- Elettronegatività, che misura la capacità di formare un legame chimico.
- Discende mentre si muove su e giù.
- Aumenta man mano che ci si sposta da sinistra a destra.
- Affinità elettronica, che si riferisce alla capacità dell'elemento di accettare un elettrone.
L'affinità elettronica può essere prevista in base ai gruppi degli elementi. I gas nobili, come l'argon e il neon, hanno un'affinità elettronica prossima allo zero e tendono a non accettare gli elettroni..
Gli alogeni, come il cloro e lo iodio, hanno elevate affinità elettroniche. La maggior parte degli altri gruppi di elementi ha affinità elettronica inferiore a quella degli allogeni, ma molto superiore a quella dei gas nobili..
Riferimenti
- Qual è lo scopo della tavola periodica? Recupero da reference.com
- Come usare una tavola periodica (2017) Recuperato da thoughtco.com
- Come sono organizzati gli elementi della tavola periodica? Recupero da reference.com
- Tavola periodica. Recuperato da wikipeda.org
- Perché è utile la tavola periodica. Recupero da reference.com


Nessun utente ha ancora commentato questo articolo.