
Tavola periodica degli elementi storia, struttura, elementi

Il tavola periodica degli elementi è uno strumento che permette di consultare le proprietà chimiche dei 118 elementi finora conosciuti. È essenziale quando si eseguono calcoli stechiometrici, si prevedono le proprietà fisiche di un elemento, li si classifica e si trovano proprietà periodiche tra tutti loro..
Gli atomi diventano più pesanti man mano che i loro nuclei aggiungono protoni e neutroni, che devono anche essere accompagnati da nuovi elettroni; altrimenti, l'elettroneutralità non sarebbe possibile. Pertanto, alcuni atomi sono molto leggeri, come l'idrogeno, e altri, super pesanti, come l'oganeson.
A chi è dovuto un simile cuore in chimica? Allo scienziato Dmitri Mendeleev, che nel 1869 (quasi 150 anni fa) pubblicò, dopo un decennio di studi teorici ed esperimenti, la prima tavola periodica nel tentativo di organizzare i 62 elementi allora conosciuti.
Per questo, Mendeleev si affidava alle proprietà chimiche, mentre allo stesso tempo Lothar Meyer pubblicava un'altra tavola periodica organizzata in base alle proprietà fisiche degli elementi..
Inizialmente il tavolo conteneva "spazi vuoti", di cui in quegli anni non si conoscevano gli elementi. Tuttavia, Mendeleev è stato in grado di prevedere molte delle sue proprietà con una precisione apprezzabile. Alcuni di questi elementi erano: germanio (che ha chiamato eka-silicio) e gallio (eka-alluminio).
Le prime tavole periodiche ordinavano gli elementi in base alle loro masse atomiche. Questo ordinamento ha rivelato una certa periodicità (ripetizione e somiglianza) nelle proprietà chimiche degli elementi; tuttavia, gli elementi di transizione non erano d'accordo con questo ordine, e nemmeno i gas nobili.
Per questo motivo è stato necessario ordinare gli elementi considerando il numero atomico (numero di protoni), anziché la massa atomica. Da qui, insieme al duro lavoro e ai contributi di molti autori, la tavola periodica di Mendeleev fu raffinata e completata..
Indice articolo
- 1 Storia della tavola periodica
- 1.1 Elementi
- 1.2 Simbologia
- 1.3 Evoluzione dello schema
- 1.4 Vite tellurica di Chancourtois (1862)
- 1.5 Ottave di Newlands (1865)
- 1.6 La tavola di Mendeleev (1869)
- 1.7 Tavola periodica di Moseley (tavola periodica attuale) - 1913
- 2 Com'è organizzato? (Struttura e organizzazione)
- 2.1 Periodi
- 2.2 Gruppi
- 2.3 Numero di protoni vs elettroni di valenza
- 3 Elementi della tavola periodica
- 3.1 Blocco s
- 3.2 blocco p
- 3.3 Elementi rappresentativi
- 3.4 Metalli di transizione
- 3.5 Metalli di transizione interni
- 3.6 Metalli e non metalli
- 3.7 Famiglie di metalli
- 3.8 Metalloidi
- 3.9 Gas
- 4 Usi e applicazioni
- 4.1 Previsione delle formule di ossido
- 4.2 Valenze degli elementi
- 4.3 Tavole periodiche digitali
- 5 Importanza della tavola periodica
- 6 Riferimenti
Storia della tavola periodica
Elementi
L'uso di elementi come base per descrivere l'ambiente (più precisamente, la natura) è stato utilizzato fin dall'antichità. Tuttavia, a quel tempo erano indicati come le fasi e gli stati della materia, e non nel modo in cui viene indicato dal Medioevo.
Gli antichi greci credevano che il pianeta in cui viviamo fosse costituito dai quattro elementi fondamentali: fuoco, terra, acqua e aria..
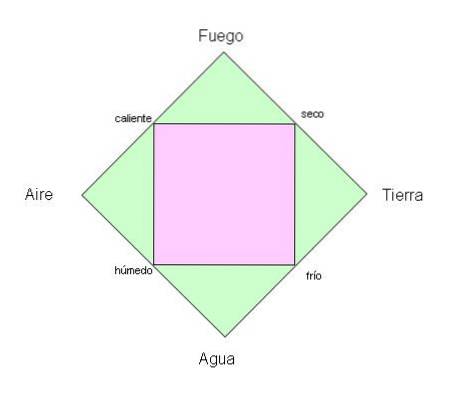
D'altra parte, nell'antica Cina il numero di elementi era cinque e, a differenza dei Greci, questi escludevano l'aria e includevano metallo e legno..

La prima scoperta scientifica fu fatta nel 1669 dal tedesco Henning Brand, che scoprì il fosforo; a partire da quella data tutte le voci successive sono state registrate.

Vale la pena chiarire che alcuni elementi come l'oro e il rame erano già conosciuti prima del fosforo; la differenza è che non sono mai stati registrati.
Simbologia
Gli alchimisti (antenati dei chimici odierni) hanno dato nomi agli elementi in relazione alle costellazioni, ai loro scopritori e ai luoghi in cui sono stati scoperti.
Nel 1808 Dalton propose una serie di disegni (simboli) per rappresentare gli elementi. Successivamente, questo sistema di annotazione è stato sostituito da quello di Jhon Berzelius (utilizzato fino ad oggi), poiché il modello di Dalton è diventato più complicato con la comparsa di nuovi elementi..
Evoluzione dello schema
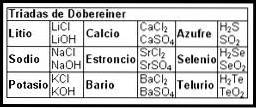
I primi tentativi di creare una mappa che organizzasse le informazioni sugli elementi chimici avvennero nel XIX secolo con le Triadi di Döbereiner (1817).
Negli anni sono stati trovati nuovi elementi che hanno dato vita a nuovi modelli organizzativi fino a quello attualmente in uso..
Chancourtois Telluric Screw (1862)
Alexandré-Émile Béguyer de Chancourtois ha progettato un'elica di carta che mostra un grafico di spirali (vite tellurica).
In questo sistema gli elementi sono ordinati in ordine crescente rispetto ai loro pesi atomici. Gli elementi simili sono allineati verticalmente.
Octaves of Newlands (1865)
Continuando con il lavoro di Döbereiner, il britannico John Alexander Reina Newlands ha disposto gli elementi chimici in ordine crescente rispetto ai pesi atomici, osservando che ogni sette elementi avevano somiglianze nelle loro proprietà (l'idrogeno non è incluso).
Tavola di Mendeleev (1869)
Mendeleev ha disposto gli elementi chimici in ordine crescente rispetto al peso atomico, mettendo nella stessa colonna quelli le cui proprietà erano simili. Ha lasciato delle lacune nel suo modello di tavola periodica anticipando la comparsa di nuovi elementi in futuro (oltre a prevedere le proprietà che dovrebbe avere).
I gas nobili non compaiono nella tavola di Mendeleev, poiché non erano ancora stati scoperti. Inoltre, Mendeleiv non ha considerato l'idrogeno.
Tavola periodica di Moseley (tavola periodica attuale) - 1913
Henry Gwyn Jeffreys Moseley propose di ordinare gli elementi chimici della tavola periodica secondo il loro numero atomico; cioè in funzione del suo numero di protoni.
Moseley enunciò la "Legge periodica" nel 1913: "Quando gli elementi sono disposti in ordine dei loro numeri atomici, le loro proprietà fisiche e chimiche mostrano tendenze periodiche".
Pertanto, ogni riga o periodo orizzontale mostra un tipo di relazione e ogni colonna o gruppo ne mostra un altro..
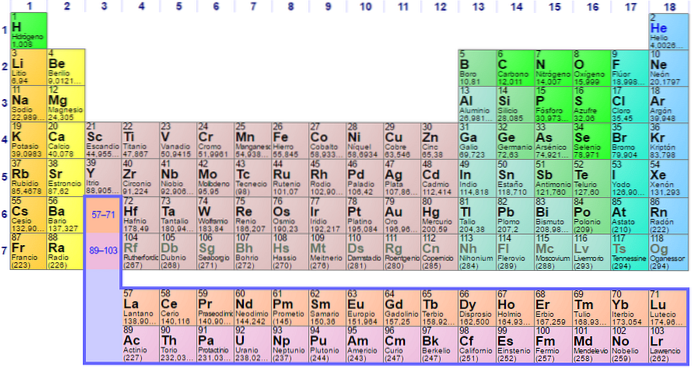
Com'è organizzato? (Struttura e organizzazione)
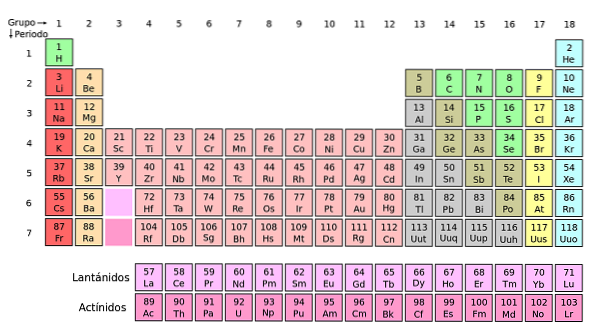
Si può vedere che il pastello della tavola periodica ha diversi colori. Ogni colore associa elementi con proprietà chimiche simili. Ci sono colonne arancioni, gialle, blu, viola; quadrati verdi e una diagonale verde mela.
Nota che le celle nelle colonne centrali sono di colore grigiastro, quindi tutti questi elementi devono avere qualcosa in comune, ovvero che sono metalli di transizione con orbitali d mezzo pieni..
Allo stesso modo, gli elementi dei quadrati viola, sebbene vadano da sostanze gassose, da un liquido rossastro a un solido nero-viola (iodio) e grigio argento (astato), sono le loro proprietà chimiche che li rendono congeneri. Queste proprietà sono regolate dalle strutture elettroniche dei suoi atomi..
L'organizzazione e la struttura della tavola periodica non è arbitraria, ma obbedisce a una serie di proprietà periodiche e modelli di valori determinati per gli elementi. Ad esempio, se il carattere metallico diminuisce da sinistra a destra del tavolo, non ci si può aspettare un elemento metallico nell'angolo in alto a destra.
Periodi
Gli elementi sono disposti in righe o periodi a seconda del livello di energia dei loro orbitali. Prima del periodo 4, quando gli elementi si succedevano in ordine crescente di massa atomica, si è scoperto che per ogni otto di essi le proprietà chimiche si ripetevano di nuovo (legge delle ottave di John Newlands).
I metalli di transizione sono stati colati con altri elementi non metallici, come zolfo e fosforo. Per questo motivo, l'ingresso della fisica quantistica e delle configurazioni elettroniche è stato vitale per la comprensione delle moderne tavole periodiche..
Gli orbitali di un guscio energetico si riempiono di elettroni (e i nuclei di protoni e neutroni) mentre si muove attraverso un periodo. Questo strato di energia va di pari passo con le dimensioni o il raggio atomico; pertanto, gli elementi dei periodi superiori sono più piccoli di quelli inferiori.
H e He sono nel primo (periodo) livello di energia; la prima fila di quadrati grigiastri, nel quarto periodo; e la fila di quadrati arancioni, nel sesto periodo. Si noti che, sebbene quest'ultimo sembri essere nel presunto nono periodo, in realtà appartiene al sesto, subito dopo la casella gialla di Ba.
Gruppi
Percorrendo un periodo si scopre che la massa, il numero di protoni ed elettroni aumentano. Nella stessa colonna o gruppo, anche se la massa e i protoni variano, il numero di elettroni del guscio di valenza è la stessa.
Ad esempio, nella prima colonna o gruppo, H ha un singolo elettrone nell'orbitale 1s1, come il Li (2s1), sodio (3s1), potassio (4s1) e così via fino al francio (7s1). Quel numero 1 denota che questi elementi difficilmente hanno un elettrone di valenza e quindi appartengono al gruppo 1 (IA). Ogni elemento è in periodi diversi.
Senza contare l'idrogeno in scatola verde, gli elementi sottostanti sono in scatola arancione e sono chiamati metalli alcalini. Un'altra casella a destra in qualsiasi periodo, è il gruppo o la colonna 2; cioè, i suoi elementi hanno due elettroni di valenza.
Ma quando ci si sposta un passo più a destra, senza la conoscenza degli orbitali d, si arriva al gruppo del boro (B) o al gruppo 13 (IIIA); invece del gruppo 3 (IIIB) o scandio (Sc). Tenendo conto del riempimento degli orbitali d, si inizia a passare attraverso i periodi dei quadrati grigiastri: i metalli di transizione.
Numero di protoni vs elettroni di valenza
Quando si studia la tavola periodica può sorgere una confusione tra il numero atomico Z o il numero di protoni totali nel nucleo e il numero di elettroni di valenza. Ad esempio, il carbonio ha Z = 6, cioè ha sei protoni e quindi sei elettroni (altrimenti non potrebbe essere un atomo a carica neutra).
Ma di quei sei elettroni, quattro sono di valencia. Per questo motivo la sua configurazione elettronica è [He] 2sDue2 PDue. [He] denota i due elettroni 1sDue dello strato chiuso e teoricamente non partecipano alla formazione di legami chimici.
Inoltre, poiché il carbonio ha quattro elettroni di valenza, "convenientemente" si trova nel gruppo 14 (IVA) della tavola periodica..
Gli elementi al di sotto del carbonio (Si, Ge, Sn, Pb e Fl) hanno numeri atomici (e masse atomiche) più elevati; ma hanno tutti i quattro elettroni di valenza in comune. Questa è la chiave per capire perché un elemento appartiene a un gruppo e non a un altro..
Elementi della tavola periodica
Blocco s
Come appena spiegato, i gruppi 1 e 2 sono caratterizzati dall'avere uno o due elettroni negli orbitali s. Questi orbitali sono di geometria sferica e quando si discende attraverso uno di questi gruppi, gli elementi acquisiscono strati che aumentano la dimensione dei loro atomi..
Poiché presentano forti tendenze nelle loro proprietà chimiche e nei modi di reagire, questi elementi sono organizzati come il blocco s. Pertanto, i metalli alcalini e i metalli alcalino terrosi appartengono a questo blocco. La configurazione elettronica degli elementi di questo blocco è ns (1s, 2s, ecc.).
Sebbene l'elemento elio si trovi nell'angolo in alto a destra della tabella, la sua configurazione elettronica è 1sDue e quindi appartiene a questo blocco.
Blocco p
A differenza del blocco s, gli elementi di questo blocco hanno orbitali completamente riempiti, mentre i loro orbitali p continuano ad essere riempiti di elettroni. Le configurazioni elettroniche degli elementi appartenenti a questo blocco sono del tipo nsDuenp1-6 (p orbitali possono avere uno o fino a sei elettroni da riempire).
Allora, dove si trova questo blocco sulla tavola periodica? A destra: i quadrati verde, viola e blu; cioè elementi non metallici e metalli pesanti, come bismuto (Bi) e piombo (Pb).
A partire dal boro, con configurazione elettronica nsDuenp1, il carbonio alla sua destra aggiunge un altro elettrone: 2sDue2 PDue. Successivamente, le configurazioni elettroniche degli altri elementi del periodo 2 del blocco p sono: 2sDue2 P3 (azoto), 2sDue2 P4 (ossigeno), 2sDue2 P5 (fluoro) e 2sDue2 P6 (neon).
Se scendi nei periodi inferiori, avrai il livello di energia 3: 3sDue3p1-6, e così via fino alla fine del blocco p.
Nota che la cosa più importante di questo blocco è che, a partire dal periodo 4, i suoi elementi hanno orbitali d completamente riempiti (riquadri blu a destra). In breve: il blocco s si trova a sinistra della tavola periodica e il blocco p a destra.
Elementi rappresentativi
Quali sono gli elementi rappresentativi? Sono quelli che, da un lato, perdono facilmente elettroni o, dall'altro, li guadagnano per completare l'ottetto di valenza. In altre parole: sono gli elementi dei blocchi se p.
I loro gruppi sono stati distinti dagli altri da una lettera A alla fine. Quindi, c'erano otto gruppi: da IA a VIIIA. Ma attualmente, il sistema di numerazione utilizzato nelle moderne tavole periodiche è l'arabo, da 1 a 18, compresi i metalli di transizione..
Per questo motivo il gruppo boro può essere IIIA, o 13 (3 + 10); il gruppo di carbonio, IVA o 14; e quello dei gas nobili, l'ultimo a destra del tavolo, VIIIA o 18.
Metalli di transizione
I metalli di transizione sono tutti gli elementi dei quadrati grigiastri. Durante i loro periodi, i loro orbitali d sono riempiti, che sono cinque e possono quindi avere dieci elettroni. Poiché devono avere dieci elettroni per riempire questi orbitali, devono esserci dieci gruppi o colonne.
Ciascuno di questi gruppi nel vecchio sistema di numerazione era designato con numeri romani e una lettera B alla fine. Il primo gruppo, quello dello scandio, era IIIB (3), quello del ferro, cobalto e nichel VIIIB per avere reattività molto simili (8, 9 e 10), e quello dello zinco IIB (12).
Come si può vedere, è molto più facile riconoscere i gruppi in base a numeri arabi che utilizzando numeri romani..
Metalli di transizione interni
A partire dal periodo 6 della tavola periodica, gli orbitali f diventano energeticamente disponibili. Questi devono essere riempiti prima degli orbitali d; e quindi, i suoi elementi sono solitamente distanziati in modo da non allungare troppo il tavolo.
Gli ultimi due periodi, arancione e grigio, sono i metalli di transizione interna, chiamati anche lantanidi (terre rare) e attinidi. Ci sono sette orbitali f, che necessitano di quattordici elettroni per riempirsi, e quindi devono esserci quattordici gruppi.
Se questi gruppi vengono aggiunti alla tavola periodica, saranno 32 in totale (18 + 14) e ci sarà una versione "lunga":
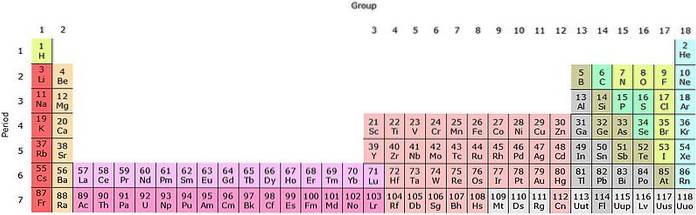
La riga rosa chiaro corrisponde ai lantanoidi, mentre la riga rosa scuro corrisponde agli attinoidi. Il lantanio, La con Z = 57, l'attinio, Ac con Z = 89 e l'intero blocco f appartengono allo stesso gruppo dello scandio. Perché? Perché lo scandio ha un orbitale nd1, che è presente nel resto dei lantanoidi e degli attinoidi.
La e Ac hanno impostazioni di valenza 5d16sDue e 6d17sDue. Mentre ti sposti a destra attraverso entrambe le righe, gli orbitali 4f e 5f iniziano a riempirsi. Una volta riempito, si arriva agli elementi lutezio, Lu e laurencio, Lr.
Metalli e non metalli
Lasciandosi alle spalle la torta della tavola periodica, è più conveniente ricorrere a quella nell'immagine in alto, anche nella sua forma allungata. Al momento la stragrande maggioranza degli elementi citati sono metalli.
A temperatura ambiente, tutti i metalli sono sostanze solide (tranne il mercurio, che è liquido) di colore grigio-argenteo (ad eccezione del rame e dell'oro). Inoltre, tendono ad essere duri e lucenti; sebbene quelli dei blocchi siano morbidi e fragili. Questi elementi sono caratterizzati dalla loro facilità di perdere elettroni e formare cationi M.+.
Nel caso dei lantanoidi, perdono tutti e tre gli elettroni 5d16sDue diventare cationi trivalenti M3+ (come lei3+). Il cerio, da parte sua, è in grado di perdere quattro elettroni (Ce4+).
D'altra parte, gli elementi non metallici costituiscono la parte minore della tavola periodica. Sono gas o solidi con atomi legati in modo covalente (come zolfo e fosforo). Tutti si trovano nel blocco p; più precisamente, nella parte alta di esso, poiché scendendo ai periodi inferiori aumenta il carattere metallico (Bi, Pb, Po).
Inoltre, i non metalli invece di perdere elettroni, li guadagni. Quindi, formano gli anioni X- con diverse cariche negative: -1 per alogeni (gruppo 17) e -2 per calcogeni (gruppo 16, ossigeno).
Famiglie metalliche
All'interno dei metalli esiste una classificazione interna per differenziarli l'uno dall'altro:
-I metalli del gruppo 1 sono alcalini
-Gruppo 2, metalli alcalino terrosi (Sig.Becambara)
-Famiglia di scandio del gruppo 3 (IIIB). Questa famiglia è composta da scandio, capo del gruppo, da ittrio Y, lantanio, attinio e da tutti i lantanoidi e attinoidi.
-Gruppo 4 (IVB), famiglia di titanio: Ti, Zr (zirconio), Hf (afnio) e Rf (ruterfordio). Quanti elettroni di valenza hanno? La risposta è nel tuo gruppo.
-Gruppo 5 (VB), famiglia vanadio. Gruppo 6 (VIB), famiglia del cromo. E così via fino alla famiglia dello zinco, gruppo 12 (IIB).
Metalloidi
Il carattere metallico aumenta da destra a sinistra e dall'alto verso il basso. Ma qual è il confine tra questi due tipi di elementi chimici? Questo confine è composto da elementi noti come metalloidi, che hanno caratteristiche sia dei metalli che dei non metalli..
I metalloidi possono essere visti sulla tavola periodica nella "scala" che inizia con il boro e termina con l'elemento radioattivo astato. Questi elementi sono:
-B: boro
-Silicio: sì
-Ge: germanio
-Come: arsenico
-Sb: antimonio
-Te: tellurio
-A: astato
Ciascuno di questi sette elementi presenta proprietà intermedie, che variano a seconda dell'ambiente chimico o della temperatura. Una di queste proprietà è la semiconduzione, cioè i metalloidi sono semiconduttori.
Gas
In condizioni terrestri, gli elementi gassosi sono quei metalli non leggeri, come azoto, ossigeno e fluoro. Inoltre, cloro, idrogeno e gas nobili rientrano in questa classificazione. Tra tutti, i più emblematici sono i gas nobili, a causa della loro bassa tendenza a reagire e comportarsi come atomi liberi..
Questi ultimi si trovano nel gruppo 18 della tavola periodica e sono:
-Elio, He
-Neon, Ne
-Argon, Ar
-krypton, Kr
-Xenon, Xe
-Radon, Rn
-E il più recente di tutti, il gas nobile sintetico oganeson, Og.
Tutti i gas nobili hanno in comune la configurazione di valenza nsDuenp6; cioè, hanno l'ottetto di valenza completo.
Stati di aggregazione di elementi ad altre temperature
Gli elementi sono allo stato solido, liquido o gassoso a seconda della temperatura e dell'intensità delle loro interazioni. Se la temperatura della Terra si raffreddasse intorno allo zero assoluto (0K), tutti gli elementi si congelerebbero; ad eccezione dell'elio, che si condenserebbe.
A questa temperatura estrema, il resto dei gas sarebbe sotto forma di ghiaccio.
All'altro estremo, se la temperatura fosse di circa 6000 K, "tutti" gli elementi sarebbero allo stato gassoso. In queste condizioni, potresti letteralmente vedere nuvole di oro, argento, piombo e altri metalli.
Usi e applicazioni
La tavola periodica di per sé è sempre stata e sarà uno strumento per consultare i simboli, le masse atomiche, le strutture e altre proprietà degli elementi. È estremamente utile quando si eseguono calcoli stechiometrici, che sono all'ordine del giorno in molte attività all'interno e all'esterno del laboratorio.
Non solo, ma anche la tavola periodica ti consente di confrontare gli elementi dello stesso gruppo o periodo. Quindi, si può prevedere come saranno certi composti degli elementi.
Previsione delle formule di ossido
Ad esempio, per gli ossidi di metalli alcalini, poiché hanno un singolo elettrone di valenza, e quindi una valenza di +1, la formula dei loro ossidi dovrebbe essere di tipo MDueO. Questo viene controllato con ossido di idrogeno, acqua, H.DueO. Anche con ossidi di sodio, NaDueO e potassio, KDueO.
Per gli altri gruppi, i loro ossidi devono avere la formula generale MDueOn, dove n è uguale al numero del gruppo (se l'elemento proviene dal blocco p, viene calcolato n-10). Pertanto, il carbonio, che appartiene al gruppo 14, forma CODue (CDueO4/Due); zolfo, dal gruppo 16, SO3 (SDueO6/Due); e azoto, gruppo 15, NDueO5.
Tuttavia, questo non si applica ai metalli di transizione. Questo perché il ferro, sebbene appartenga al gruppo 8, non può perdere 8 elettroni ma 2 o 3. Pertanto, invece di memorizzare le formule, è più importante prestare attenzione alle valenze di ogni elemento..
Valenze degli elementi
Le tavole periodiche (alcune) mostrano le possibili valenze per ogni elemento. Sapendo questi, la nomenclatura di un composto e la sua formula chimica possono essere stimati in anticipo. Le valenze, come accennato in precedenza, sono legate al numero del gruppo; sebbene non si applichi a tutti i gruppi.
Le valenze dipendono maggiormente dalla struttura elettronica degli atomi e da quali elettroni possono effettivamente perdere o guadagnare..
Conoscendo il numero di elettroni di valenza, puoi anche iniziare con la struttura di Lewis di un composto da queste informazioni. La tavola periodica consente quindi a studenti e professionisti di abbozzare strutture e di dare spazio ad un sondaggio di possibili geometrie e strutture molecolari..
Tavole periodiche digitali
Oggi la tecnologia ha permesso alle tavole periodiche di essere più versatili e fornire maggiori informazioni a disposizione di tutti. Molti di loro portano illustrazioni sorprendenti di ogni elemento, oltre a un breve riassunto dei suoi usi principali.
Il modo in cui interagisci con loro accelera la tua comprensione e studio. La tavola periodica dovrebbe essere uno strumento piacevole alla vista, facile da esplorare e il metodo più efficace per conoscerne gli elementi chimici è passare attraverso di essa da periodi a gruppi..
Importanza della tavola periodica
Oggi, la tavola periodica è lo strumento di organizzazione più importante in chimica grazie alle relazioni dettagliate dei suoi elementi. Il suo utilizzo è fondamentale sia per studenti e docenti che per ricercatori e molti professionisti dedicati al ramo della chimica e dell'ingegneria..
Basta guardare la tavola periodica per ottenere un'immensa quantità e informazioni in modo rapido ed efficiente, come ad esempio:
- Il litio (Li), il berillio (Be) e il boro (B) conducono l'elettricità.
- Il litio è un metallo alcalino, il berillio è un metallo alcalino terroso e il boro è un non metallo.
- Il litio è il miglior conduttore dei tre citati, seguito dal berillio e, infine, dal boro (semiconduttore).
Quindi, individuando questi elementi nella tavola periodica, la loro tendenza alla conduttività elettrica può essere immediatamente conclusa..
Riferimenti
- Scerri, E. (2007). La tavola periodica: la sua storia e il suo significato. Oxford New York: Oxford University Press.
- Scerri, E. (2011). La tavola periodica: una brevissima introduzione. Oxford New York: Oxford University Press.
- Moore, J. (2003). Chimica per manichini. New York, NY: Wiley Pub.
- Venable, F.P… (1896). Lo sviluppo della legge periodica. Easton, Pennsylvania: Chemical Publishing Company.
- Ball, P. (2002). Gli ingredienti: una visita guidata agli elementi. Oxford New York: Oxford University Press.
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Royal Society of Chemistry. (2018). Tavola periodica. Estratto da: rsc.org
- Richard C. Banks. (Gennaio 2001). La tavola periodica. Estratto da: chemistry.boisestate.edu
- Fisica 2000. (s.f.). L'origine della tavola periodica. Estratto da: physics.bk.psu.edu
- King K. e Nazarewicz W. (7 giugno 2018). C'è una fine alla tavola periodica? Recupero da: msutoday.msu.edu
- Dr. Doug Stewart. (2018). La tavola periodica. Estratto da: chemicool.com
- Mendez A. (16 aprile 2010). La tavola periodica di Mendeleev. Estratto da: quimica.laguia2000.com


Nessun utente ha ancora commentato questo articolo.