
Struttura, proprietà, usi e sintesi del ciclobutano

Il ciclobutano è un idrocarburo costituito da un cicloalcano a quattro atomi di carbonio, la cui formula molecolare è C4H8. Può anche essere chiamato tetrametilene, considerando che sono quattro unità CHDue che compongono un anello a geometria quadrata, anche se il nome ciclobutano è più accettato e conosciuto.
A temperatura ambiente è un gas incolore e infiammabile che brucia con una fiamma brillante. Il suo uso più primitivo è come fonte di calore quando lo brucia; Tuttavia, la sua base strutturale (il quadrato) racchiude profondi aspetti biologici e chimici e collabora in un certo modo con le proprietà di questi composti..
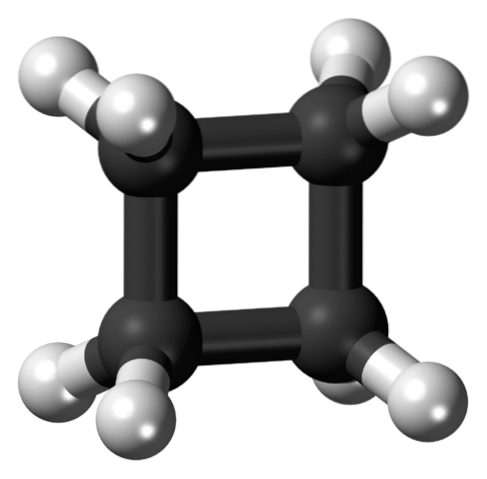
L'immagine in alto mostra una molecola di ciclobutano con una struttura quadrata. Nella prossima sezione spiegheremo perché questa conformazione è instabile, poiché i suoi collegamenti sono tesi..
Dopo il ciclopropano, è il cicloalcano più instabile, poiché minore è la dimensione dell'anello, più reattivo sarà. Secondo questo, il ciclobutano è più instabile dei cicli pentano ed esano. Tuttavia è curioso assistere nelle sue derivate a un nucleo o cuore quadrato, che, come si vedrà, è dinamico.
Indice articolo
- 1 Struttura del ciclobutano
- 1.1 conformazioni a farfalla o rugose
- 1.2 Interazioni intermolecolari
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Massa molecolare
- 2.3 Punto di ebollizione
- 2.4 Punto di fusione
- 2.5 Punto di infiammabilità
- 2.6 Solubilità
- 2.7 Densità
- 2.8 Densità del vapore
- 2.9 Pressione di vapore
- 2.10 Indice di rifrazione
- 2.11 Entalpia di combustione
- 2.12 Calore di formazione
- 3 Sintesi
- 4 Usi
- 5 Riferimenti
Struttura del ciclobutano
Nella prima immagine, la struttura del ciclobutano è stata affrontata come un semplice quadrato carbonizzato e idrogenato. Tuttavia, in questo quadrato perfetto gli orbitali subiscono una forte torsione rispetto ai loro angoli originali: sono separati da un angolo di 90º rispetto a 109,5º per un atomo di carbonio con ibridazione sp.3 (stress angolare).
Atomi di carbonio sp3 sono tetraedrici e per alcuni tetraedri sarebbe difficile flettere i loro orbitali così tanto da creare un angolo di 90º; ma lo sarebbe ancora di più per i carboni con ibridazioni spDue (120º) e sp (180º) deviano dai loro angoli originali. Per questo motivo il ciclobutano ha sp atomi di carbonio3 in sostanza.
Inoltre, gli atomi di idrogeno sono molto vicini tra loro, eclissati nello spazio. Ciò si traduce in un aumento dell'impedimento sterico, che indebolisce il presunto quadrato a causa del suo elevato stress torsionale..
Pertanto, le sollecitazioni angolari e torsionali (incapsulate nel termine "tensione dell'anello") rendono questa conformazione instabile in condizioni normali..
La molecola del ciclobutano cercherà di ridurre entrambi gli stress e per ottenere ciò adotta la cosiddetta conformazione a farfalla o raggrinzita..
Conformazioni a farfalla o rugose
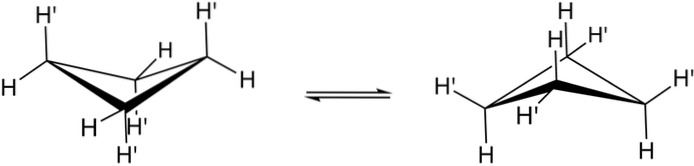
Le vere conformazioni del ciclobutano sono mostrate sopra. In essi diminuiscono le sollecitazioni angolari e torsionali; poiché, come si può vedere, ora non tutti gli atomi di idrogeno sono eclissati. Tuttavia, c'è un costo energetico: l'angolo delle sue maglie è affilato, cioè scende da 90 a 88º.
Si noti che può essere paragonato a una farfalla, le cui ali triangolari sono composte da tre atomi di carbonio; e il quarto, posizionato ad un angolo di 25º rispetto a ciascuna ala. Le frecce a due vie indicano che c'è un equilibrio tra entrambi i conformeri. È come se la farfalla fosse scesa e avesse alzato le ali.
Nei derivati del ciclobutano, d'altra parte, ci si aspetterebbe che questo sbattimento sia molto più lento e impedito spazialmente..
Interazioni intermolecolari
Supponiamo che ti dimentichi dei quadrati per un momento e che vengano sostituiti da farfalle gassate. Questi nel loro sbattere possono essere tenuti insieme nel liquido solo dalle forze di dispersione di Londra, che sono proporzionali all'area delle loro ali e alla loro massa molecolare..
Proprietà
Aspetto fisico
Gas incolore.
Massa molecolare
56,107 g / mol.
Punto di ebollizione
12,6 ° C. Pertanto, a basse temperature potrebbe essere maneggiato in linea di principio come qualsiasi liquido; con l'unico dettaglio, che sarebbe altamente volatile, ei suoi vapori rappresenterebbero comunque un rischio da tenere in considerazione.
Punto di fusione
-91ºC.
punto di accensione
Vetro chiuso a 50ºC.
Solubilità
Insolubile in acqua, il che non sorprende data la sua natura non polare; ma è leggermente solubile in alcoli, etere e acetone, che sono solventi meno polari. Si prevede che sia solubile (sebbene non riportato) logicamente in solventi apolari come tetracloruro di carbonio, benzene, xilene, ecc..
Densità
0,7125 a 5ºC (rispetto a 1 dell'acqua).
Densità del vapore
1,93 (rispetto a 1 dell'aria). Ciò significa che è più denso dell'aria e quindi, a meno che non ci siano correnti, la sua tendenza non sarà quella di salire..
Pressione del vapore
1.180 mmHg a 25 ° C.
Indice di rifrazione
1,3625 a 290 ° C.
Entalpia di combustione
-655,9 kJ / mol.
Calore di formazione
6,6 Kcal / mol a 25ºC.
Sintesi
Il ciclobutano è sintetizzato per idrogenazione del ciclobutadiene, la cui struttura è pressoché la stessa, con l'unica differenza che ha un doppio legame; e quindi è ancora più reattivo. Questa è forse la via sintetica più semplice per ottenerla, o almeno solo ad essa e non a un derivato.
Nel petrolio è improbabile che si ottenga poiché finirebbe per reagire in modo tale da rompere l'anello e formare la catena della linea, cioè l'n-butano.
Un altro metodo per ottenere il ciclobutano consiste nel colpire la radiazione ultravioletta sulle molecole di etilene, CHDue= CHDue, che dimerizzano. Questa reazione è favorita fotochimicamente, ma non termodinamicamente:
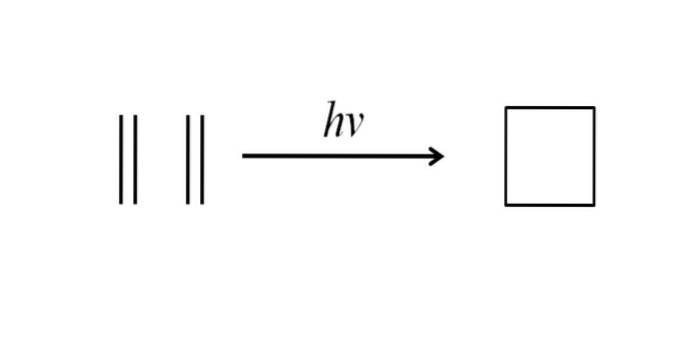
L'immagine sopra riassume molto bene quanto detto nel paragrafo precedente. Se invece dell'etilene si avesse, ad esempio, due alcheni qualsiasi, si otterrebbe un ciclobutano sostituito; o quello che è lo stesso, un derivato del ciclobutano. In effetti, molti derivati con strutture interessanti sono stati sintetizzati con questo metodo..
Altri derivati, tuttavia, comportano una serie di passaggi sintetici complicati. Pertanto, i ciclobutani (come vengono chiamati i loro derivati) sono oggetto di studio per le sintesi organiche..
Applicazioni
Il ciclobutano da solo non ha altra utilità che servire come fonte di calore; ma, i suoi derivati, entrano in un terreno intricato nella sintesi organica, con applicazioni in farmacologia, biotecnologia e medicina. Senza addentrarsi in strutture eccessivamente complesse, penitrem e grandisol sono esempi di ciclobutani.
I ciclobutani hanno generalmente proprietà benefiche per il metabolismo di batteri, piante, invertebrati marini e funghi. Sono biologicamente attivi, ed è per questo che i loro usi sono molto vari e difficili da specificare, poiché ognuno ha il suo effetto particolare su determinati organismi..
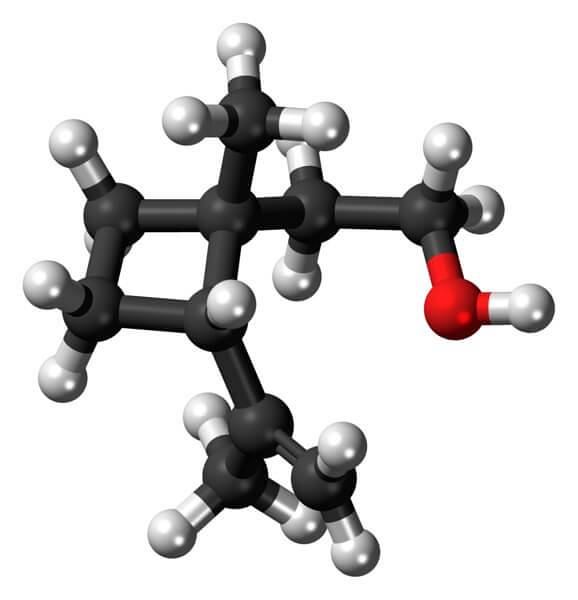
Grandisol, ad esempio, è un feromone del tonchio (un tipo di coleottero). Sopra, ed infine, è mostrata la sua struttura, considerata un monoterpene a base quadrata di ciclobutano.
Riferimenti
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons, T.W .; Craig B. Fryhle. (2011). Chimica organica. (undicith edizione). Wiley.
- Wikipedia. (2019). Ciclobutano. Estratto da: en.wikipedia.org
- PubChem. (2019). Ciclobutano. Estratto da: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (2015, 29 novembre). Proprietà fisiche dei cicloalcani. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Proprietà fisiche del ciclobutano e studi teorici. Dipartimento di Chimica, Università di Yale.
- Klement Foo. (s.f.). Ciclobutani in sintesi organica. Recupero da: scripps.edu
- Myers. (s.f.). Sintesi dei ciclobutani. Chem 115. Estratto da: hwpi.harvard.edu



Nessun utente ha ancora commentato questo articolo.