
Struttura, proprietà e usi del bromuro d'argento (AgBr)
Il bromuro d'argento è un sale inorganico la cui formula chimica è AgBr. Il suo solido è costituito da cationi Ag+ e anioni Br- in rapporto 1: 1, attratto da forze elettrostatiche o legami ionici. Si può vedere come se l'argento metallico avesse dato uno dei suoi elettroni di valenza al bromo molecolare.
La sua natura ricorda i suoi "fratelli" cloruro d'argento e ioduro. Tutti e tre i sali sono insolubili in acqua, hanno colori simili e sono anche sensibili alla luce; cioè, subiscono reazioni fotochimiche. Questa proprietà è stata utilizzata per ottenere fotografie, come risultato della riduzione degli ioni Ag+ all'argento metallizzato.
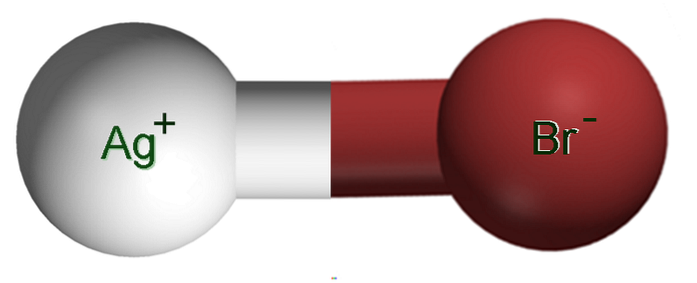
L'immagine sopra mostra una coppia ionica Ag+Br-, in cui le sfere bianche e marroni corrispondono agli ioni Ag+ e fr-, rispettivamente. Qui rappresentano il legame ionico come Ag-Br, ma è necessario indicare che non esiste un tale legame covalente tra entrambi gli ioni.
Può sembrare contraddittorio che l'argento sia quello che contribuisce con il colore nero alle fotografie senza colore. Questo perché l'AgBr reagisce con la luce, generando un'immagine latente; che, poi, si intensifica aumentando la riduzione dell'argento.
Indice articolo
- 1 Struttura del bromuro d'argento
- 1.1 Difetti di cristallo
- 2 Sintesi
- 3 Proprietà
- 3.1 Aspetto
- 3.2 Massa molecolare
- 3.3 Densità
- 3.4 Punto di fusione
- 3.5 Punto di ebollizione
- 3.6 Solubilità in acqua
- 3.7 Indice di rifrazione
- 3.8 Capacità termica
- 3.9 Sensibilità alla luce
- 4 Usi
- 5 Riferimenti
Struttura del bromuro d'argento
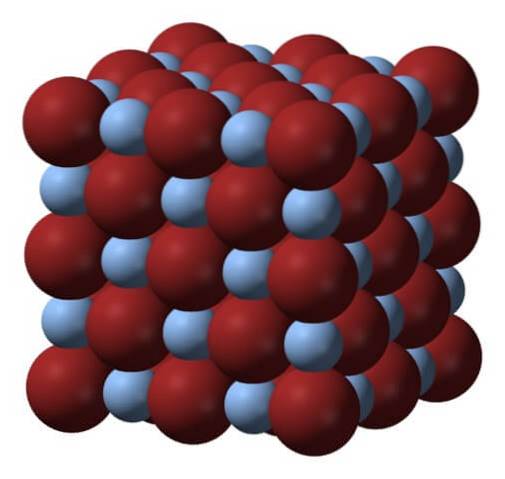
Sopra è il reticolo o la struttura cristallina del bromuro d'argento. Ecco una rappresentazione più fedele della differenza di dimensioni tra i raggi ionici di Ag+ e fr-. Anioni Br-, più voluminose, lasciano interstizi dove si trovano i cationi Ag+, che è circondato da sei fr- (e viceversa).
Questa struttura è caratteristica di un sistema cristallino cubico, nello specifico del tipo salgemma; lo stesso, ad esempio, del cloruro di sodio, NaCl. In effetti, l'immagine facilita ciò disponendo un perfetto confine cubico.
A prima vista si può vedere che c'è una certa differenza di dimensioni tra gli ioni. Questo, e forse le caratteristiche elettroniche dell'Ag+ (e il possibile effetto di alcune impurità), fa sì che i cristalli di AgBr presentino dei difetti; cioè, luoghi in cui la sequenza di ordinamento degli ioni nello spazio è "interrotta".
Difetti di cristallo
Questi difetti sono costituiti da vuoti lasciati da ioni assenti o spostati. Ad esempio, tra sei anioni Br- normalmente dovrebbe essere il catione Ag+; ma invece, potrebbe esserci un vuoto dovuto all'argento che si è spostato in un altro spazio (difetto di Frenkel).
Sebbene influenzino il reticolo cristallino, favoriscono le reazioni dell'argento con la luce; e più grandi sono i cristalli o il loro grappolo (dimensione dei grani), maggiore è il numero di difetti e quindi sarà più sensibile alla luce. Allo stesso modo, le impurità influenzano la struttura e questa proprietà, specialmente quelle che possono essere ridotte con gli elettroni..
Come conseguenza di quest'ultimo, i cristalli di AgBr di grandi dimensioni richiedono una minore esposizione alla luce per ridurli; cioè, sono più desiderabili per scopi fotografici.
Sintesi
In laboratorio, il bromuro d'argento può essere sintetizzato miscelando una soluzione acquosa di nitrato d'argento, AgNO3, con il sale di bromuro di sodio, NaBr. Il primo sale fornisce l'argento e il secondo il bromuro. Quella che segue è una reazione di doppio spostamento o metatesi che può essere rappresentata dall'equazione chimica seguente:
AgNO3(aq) + NaBr (s) => NaNO3(aq) + AgBr (s)
Si noti che il sale di nitrato di sodio, NaNO3, è solubile in acqua, mentre AgBr precipita come un solido di colore giallo tenue. Successivamente il solido viene lavato e sottoposto ad essiccazione sotto vuoto. Oltre a NaBr, KBr potrebbe anche essere utilizzato come fonte di anioni bromuro.
AgBr, invece, può essere ottenuto naturalmente attraverso la sua bromirite minerale e i suoi dovuti processi di purificazione..
Proprietà
Aspetto
Solido giallo-biancastro simile all'argilla.
Massa molecolare
187,77 g / mol.
Densità
6,473 g / mL.
Punto di fusione
432 ° C.
Punto di ebollizione
1502 ° C.
Solubilità dell'acqua
0,140 g / mL a 20 ° C.
Indice di rifrazione
2.253.
Capacità termica
270 J / Kg K.
Sensibilità alla luce
Si è detto nella sezione precedente che ci sono difetti nei cristalli di AgBr che promuovono la sensibilità di questo sale alla luce, poiché intrappolano gli elettroni formati; e quindi, in teoria, viene loro impedito di reagire con altre specie nell'ambiente, come l'ossigeno nell'aria.
L'elettrone viene rilasciato dalla reazione Br- con un fotone:
Br- + hv => 1 / 2BrDue + e-
Si noti che viene prodotto BrDue, che macchierà il rosso solido se non viene rimosso. Gli elettroni rilasciati riducono i cationi Ag+, nei suoi interstizi, all'argento metallico (talvolta rappresentato come Ag0):
Ag+ + e- => Ag
Avendo quindi l'equazione netta:
AgBr => Ag + 1 / 2BrDue
Quando i "primi strati" di argento metallico si formano sulla superficie, si dice che ci sia un'immagine latente, ancora invisibile all'occhio umano. Questa immagine diventa milioni di volte più visibile se un'altra specie chimica (come l'idrochinone e il fenidone, nel processo di sviluppo) aumenta la riduzione dei cristalli di AgBr ad argento metallico.
Applicazioni

Il bromuro d'argento è il più utilizzato tra tutti i suoi alogenuri nel campo dello sviluppo di pellicole fotografiche. Su dette pellicole viene applicato AgBr, a base di acetato di cellulosa, sospeso in gelatina (emulsione fotografica), e in presenza di 4- (metilammino) fenolo solfato (Metol) o fenidone, e idrochinone.
Con tutti questi reagenti, l'immagine latente può essere portata in vita; rifinire e accelerare la trasformazione dell'argento ionico in argento metallizzato. Ma, se non si procede con una certa cura ed esperienza, tutto l'argento sulla superficie si ossiderà e il contrasto tra i colori bianco e nero terminerà..
Ecco perché le fasi di arresto, fissazione e lavaggio delle pellicole fotografiche sono vitali..
Ci sono artisti che giocano con questi processi in modo tale da creare sfumature di grigio, che arricchiscono la bellezza dell'immagine e la propria eredità; e fanno tutto questo, a volte forse senza sospettarlo, grazie a reazioni chimiche, le cui basi teoriche possono diventare un po 'complesse, e ad un AgBr fotosensibile che segna un punto di partenza.
Riferimenti
- Wikipedia. (2019). Bromuro d'argento. Estratto da: en.wikipedia.org
- Michael W. Davidson. (2015, 13 novembre). Galleria di immagini digitali a luce polarizzata: bromuro d'argento. Olympus. Recupero da: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Bromuro d'argento (AgBr). Estratto da: crystran.co.uk
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann e Claudia Schneeweiss. (29 giugno 2004). Emulsioni a base di bromuro d'argento autoprodotte per utenti in olografia: produzione, lavorazione e applicazione, Proc. SPIE 5290, Olografia pratica XVIII: materiali e applicazioni; doi: 10.1117 / 12.525035; https://doi.org/10.1117/12.525035
- Alan G. Shape. (1993). Chimica inorganica. (Seconda edizione.). Reverté editoriale.
- Carlos Güido e Ma Eugenia Bautista. (2018). Introduzione alla chimica fotografica. Estratto da: fotografia.ceduc.com.mx
- García D. Bello. (9 gennaio 2014). Chimica, fotografia e Chema Madoz. Estratto da: dimethylsulfuro.es

Nessun utente ha ancora commentato questo articolo.