
Proprietà degli esteri, struttura, usi, esempi
Il esteri Sono composti organici che hanno una componente di acido carbossilico e una componente alcolica. La sua formula chimica generale è RCODueR' o RCOOR'. Il lato destro, RCOO, corrisponde al gruppo carbossilico, mentre il lato destro, OR' è alcol. I due condividono un atomo di ossigeno e condividono una certa somiglianza con gli eteri (ROR ').
Per questo motivo acetato di etile, CH3COOCHDueCH3, il più semplice degli esteri, era considerato come il acido acetico o etere di aceto, e da qui l'origine etimologica del nome "estere". Quindi un estere consiste nella sostituzione dell'idrogeno acido del gruppo COOH, con un gruppo alchilico da un alcol.

Dove si trovano gli esteri? Dai terreni alla chimica organica, le sue fonti naturali sono molte. Il gradevole odore di frutta, come banane, pere e mele, è il prodotto dell'interazione degli esteri con molti altri componenti. Si trovano anche sotto forma di trigliceridi negli oli o nei grassi.
Il nostro corpo produce trigliceridi dagli acidi grassi, che hanno lunghe catene di carbonio e alcol glicerico. Ciò che differenzia alcuni esteri da altri risiede sia in R, la catena della componente acida, sia in R ', quella della componente alcolica..
Un estere a basso peso molecolare deve avere pochi atomi di carbonio in R e R ', mentre altri, come le cere, hanno molti atomi di carbonio soprattutto in R', la componente alcolica, e quindi alti pesi molecolari..
Tuttavia, non tutti gli esteri sono rigorosamente organici. Se l'atomo di carbonio del gruppo carbonile viene sostituito da uno di fosforo, avremo RPOOR '. Questo è noto come estere fosfato e sono di fondamentale importanza nella struttura del DNA..
Pertanto, fintanto che un atomo può legarsi in modo efficiente al carbonio o all'ossigeno, come lo zolfo (RSOOR '), di conseguenza può formare un estere inorganico.
Indice articolo
- 1 Proprietà
- 1.1 Solubilità in acqua
- 1.2 Reazione di idrolisi
- 1.3 Reazione di riduzione
- 1.4 Reazione di transesterificazione
- 2 Struttura
- 2.1 Accettore di legame idrogeno
- 3 Nomenclatura
- 4 Come si formano?
- 4.1 Esterificazione
- 4.2 Esteri da cloruri acilici
- 5 Usi
- 6 esempi
- 7 Riferimenti
Proprietà
Gli esteri non sono né acidi né alcoli, quindi non si comportano come tali. I loro punti di fusione e di ebollizione, ad esempio, sono inferiori a quelli con pesi molecolari simili, ma più vicini nei valori a quelli di aldeidi e chetoni..
Acido butanoico, CH3CHDueCHDueCOOH, ha un punto di ebollizione di 164ºC, mentre l'acetato di etile, CH3COOCHDueCH3, di 77,1ºC.
A parte il recente esempio, i punti di ebollizione del 2-metilbutano, CH3CH (CH3) CHDueCH3, di acetato di metile, CH3COOCH3, e 2-butanolo, CH3,CH (OH) CHDueCH3, sono i seguenti: 28, 57 e 99 ° C. Tutti e tre i composti hanno pesi molecolari 72 e 74 g / mol..
Gli esteri a basso peso molecolare tendono ad essere volatili e hanno odori gradevoli, motivo per cui il loro contenuto nella frutta conferisce loro le fragranze familiari. D'altra parte, quando i loro pesi molecolari sono elevati, sono solidi cristallini incolori e inodori o, a seconda della loro struttura, presentano caratteristiche untuose..
Solubilità dell'acqua
Gli acidi carbossilici e gli alcoli sono generalmente solubili in acqua, a meno che non abbiano un elevato carattere idrofobo nelle loro strutture molecolari. Lo stesso vale per gli esteri. Quando R o R 'sono catene corte, l'estere può interagire con le molecole d'acqua attraverso le forze dipolo-dipolo e le forze di Londra..
Questo perché gli esteri sono accettori di legami idrogeno. Come? Dai suoi due atomi di ossigeno RCOOR '. Le molecole d'acqua formano legami idrogeno con uno qualsiasi di questi ossigeni. Ma quando le catene R o R 'sono molto lunghe, respingono l'acqua nel loro ambiente, rendendone impossibile la dissoluzione..
Un ovvio esempio di ciò si verifica con gli esteri dei trigliceridi. Le sue catene laterali sono lunghe e rendono oli e grassi insolubili in acqua, a meno che non siano a contatto con un solvente meno polare, più simile a queste catene..
Reazione di idrolisi
Gli esteri possono anche reagire con le molecole d'acqua in quella che è nota come reazione di idrolisi. Tuttavia, richiedono un mezzo sufficientemente acido o basico per promuovere il meccanismo di detta reazione:
RCOOR ' + HDueO <=> RCOOh + R'OH
(Mezzo acido)
La molecola d'acqua si aggiunge al gruppo carbonile, C = O. L'idrolisi acida è riassunta nella sostituzione di ogni R 'della componente alcolica con un OH dell'acqua. Notare anche come l'estere "si rompe" nei suoi due componenti: l'acido carbossilico, RCOOH e l'alcol R'OH..
RCOOR ' + Oh- => RCOO- + R'OH
(Mezzo di base)
Quando l'idrolisi viene eseguita in un mezzo basico, si verifica una reazione irreversibile nota come saponificazione. Questo è ampiamente utilizzato ed è la pietra angolare nella produzione di saponi artigianali o industriali..
Il RCOO- è l'anione carbossilato stabile, che si associa elettrostaticamente al catione predominante nel mezzo.
Se la base utilizzata è NaOH, si forma il sale RCOONa. Quando l'estere è un trigliceride, che per definizione ha tre catene laterali R, si formano tre sali di acidi grassi, RCOONa, e l'alcol glicerolo.
Reazione di riduzione
Gli esteri sono composti altamente ossidati. Cosa significa? Significa che ha diversi legami covalenti con l'ossigeno. Eliminando i legami C-O si verifica una rottura che finisce per separare le componenti acide e alcoliche; Inoltre, l'acido si riduce a una forma meno ossidata, ad un alcol:
RCOOR '=> RCHDueOH + R'OH
Questa è la reazione di riduzione. È necessario un forte agente riducente, come l'idruro di litio alluminio, LiAlH4, e da un mezzo acido che promuove la migrazione degli elettroni. Gli alcoli sono le forme più piccole, cioè quelle con i legami meno covalenti con l'ossigeno (solo uno: C-OH).
I due alcoli, RCHDueOH + R'OH, derivano dalle due rispettive catene dell'estere originale RCOOR '. Questo è un metodo di sintesi di alcoli a valore aggiunto dai loro esteri. Ad esempio, se volessi fare un alcol da una fonte esotica di esteri, questa sarebbe una buona strada per quello scopo..
Reazione di transesterificazione
Gli esteri possono essere trasformati in altri se reagiscono in ambienti acidi o basici con alcoli:
RCOOR ' + R "OH <=> RCOO " + R'OH
Struttura
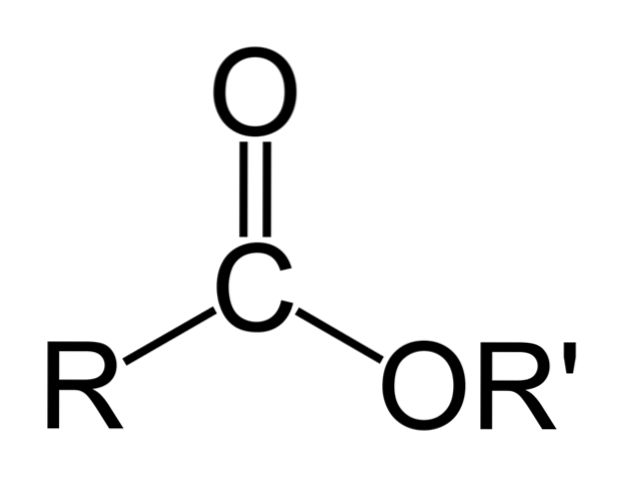
L'immagine in alto rappresenta la struttura generale di tutti gli esteri organici. Si noti che R, il gruppo carbonile C = O e OR ', formano un triangolo piatto, prodotto dell'ibridazione spDue dell'atomo di carbonio centrale. Tuttavia, gli altri atomi possono adottare altre geometrie e le loro strutture dipendono dalla natura intrinseca di R o R '.
Se R o R 'sono catene alchiliche semplici, ad esempio, del tipo (CHDue)nCH3, questi appariranno a zig-zag nello spazio. Questo è il caso del pentil butanoato, CH3CHDueCHDueCOOCHDueCHDueCHDueCHDueCH3.
Ma in uno qualsiasi degli atomi di carbonio di queste catene si potrebbe trovare una ramificazione o insaturazione (C = C, C≡C), che modificherebbe la struttura globale dell'estere. E per questo motivo le sue proprietà fisiche, come la solubilità e i suoi punti di ebollizione e fusione, variano con ogni composto..
Ad esempio, i grassi insaturi hanno doppi legami nelle loro catene R, che influenzano negativamente le interazioni intermolecolari. Di conseguenza, i loro punti di fusione diminuiscono, fino a quando non sono liquidi, o oli, a temperatura ambiente..
Accettore di legame idrogeno
Sebbene il triangolo dello scheletro di estere risalti maggiormente nell'immagine, sono le catene R e R 'che sono responsabili della diversità nelle loro strutture.
Tuttavia, il triangolo merita una caratteristica strutturale degli esteri: sono accettori di legami idrogeno. Come? Attraverso l'ossigeno dei gruppi carbonile e alcossido (il -OR ').
Questi hanno coppie di elettroni liberi, che possono attrarre atomi di idrogeno con carica parzialmente positiva dalle molecole d'acqua..
Pertanto, è un tipo speciale di interazioni dipolo-dipolo. Le molecole d'acqua si avvicinano all'estere (se non impedite dalle catene R o R ') e si formano i ponti C = O-HDueO, o OHDue-O '.
Nomenclatura
Come vengono denominati gli esteri? Per denominare correttamente un estere è necessario tenere conto dei numeri di carbonio delle catene R e R '. Allo stesso modo, ogni possibile ramificazione, sostituente o insaturazione.
Fatto ciò, al nome di ciascuna R 'del gruppo alcossido -OR' si aggiunge il suffisso -il, mentre alla catena R del gruppo carbossilico -COOR, il suffisso -ato. La sezione R viene menzionata per prima, seguita dalla parola "di" e quindi dal nome della sezione R ".
Ad esempio, il CH3CHDueCHDueCOOCHDueCHDueCHDueCHDueCH3 Ha cinque atomi di carbonio sul lato destro, cioè corrispondono a R '. E sul lato sinistro ci sono quattro atomi di carbonio (incluso il gruppo carbonile C = O). Pertanto, R 'è un gruppo pentile e R un butano (per includere il carbonile e considerare la catena principale).
Quindi, per nominare il composto, aggiungi i suffissi corrispondenti e nominali nell'ordine corretto: butanolegato di pentilo.
Come denominare il seguente composto: CH3CHDueCOOC (CH3)3? La stringa -C (CH3)3 corrisponde al sostituente terz-butilalchilico. Poiché il lato sinistro ha tre atomi di carbonio, è un "propano". Il suo nome quindi è: propanolegato di tert-butilo.
Come si formano?
Esterificazione
Esistono molti percorsi per sintetizzare l'estere, alcuni dei quali possono anche essere nuovi. Tuttavia, convergono tutti sul fatto che il triangolo nell'immagine della struttura deve essere formato, cioè il legame CO-O. Per questo, devi partire da un composto che in precedenza ha il gruppo carbonile: come un acido carbossilico.
E a cosa dovrebbe legarsi l'acido carbossilico? Ad un alcol, altrimenti non avrebbe la componente alcolica che caratterizza gli esteri. Tuttavia, gli acidi carbossilici richiedono calore e acidità per consentire al meccanismo di reazione di procedere. La seguente equazione chimica rappresenta quanto sopra detto:
RCOOH + R'OH <=> RCOOR '+ HDueO
(Mezzo acido)
Questo è noto come esterificazione.
Ad esempio, gli acidi grassi possono essere esterificati con metanolo, CH3OH, per sostituire la sua H acida con gruppi metilici, quindi questa reazione può anche essere considerata come metilazione. Questo è un passaggio importante per determinare il profilo degli acidi grassi di determinati oli o grassi..
Esteri da cloruri acilici
Un altro modo per sintetizzare gli esteri è dai cloruri acilici, RCOCl. In essi, invece di sostituire un gruppo idrossile OH, l'atomo di Cl viene sostituito:
RCOCl + R'OH => RCOOR '+ HCl
E a differenza dell'esterificazione di un acido carbossilico, non viene rilasciata acqua ma acido cloridrico.
Altri metodi sono disponibili nel mondo della chimica organica, come l'ossidazione Baeyer-Villiger, che utilizza perossiacidi (RCOOOH)..
Applicazioni

Tra i principali usi degli esteri ci sono:
-Nel fare candele o candele, come quella nell'immagine sopra. A questo scopo vengono utilizzati esteri di catena laterale molto lunghi..
-Come conservanti di medicinali o alimenti. Ciò è dovuto all'azione dei parabeni, che altro non sono che esteri dell'acido paraidrossibenzoico. Sebbene preservino la qualità del prodotto, ci sono studi che ne mettono in dubbio l'effetto positivo sul corpo.
-Sono utilizzati per la produzione di fragranze artificiali che imitano l'odore e il gusto di molti frutti o fiori. Pertanto, gli esteri sono presenti in dolci, gelati, profumi, cosmetici, saponi, shampoo, tra gli altri prodotti commerciali che meritano aromi o sapori attraenti..
-Gli esteri possono anche avere un effetto farmacologico positivo. Per questo motivo l'industria farmaceutica si è dedicata alla sintesi di esteri derivati da acidi presenti nell'organismo per valutare ogni possibile miglioramento nella cura delle malattie. L'aspirina è uno degli esempi più semplici di questi esteri.
-Gli esteri liquidi, come l'acetato di etile, sono solventi adatti per alcuni tipi di polimeri, come la nitrocellulosa e un'ampia gamma di resine.
Esempi
Alcuni esempi aggiuntivi di esteri sono i seguenti:
-Butanoato di pentile, CH3CHDueCHDueCOOCHDueCHDueCHDueCHDueCH3, che profuma di albicocca e pera.
-Acetato di vinile, CH3COOCHDue= CHDue, da cui viene prodotto il polimero di acetato di polivinile.
-Pentanoato di isopentile, CH3CHDueCHDueCHDueCOOCHDueCHDueCH (CH3)Due, che imita il gusto delle mele.
-Propanoato di etile, CH3CHDueCOOCHDueCH3.
-Metanoato di propile, HCOOCHDueCHDueCH3.
Riferimenti
- T.W. Graham Solomons, Craigh B. Fryhle. Chimica organica. (Decima edizione, p 797-802, 820) Wiley Plus.
- Carey, F. A. Organic Chemistry (2006) sesta edizione. Casa editrice Mc Graw Hill-
- Chemistry LibreTexts. Nomenclatura degli esteri. Recupero da: chem.libretexts.org
- Admin. (2015, 19 settembre). Esteri: natura chimica, proprietà e usi. Tratto da: pure-chemical.com
- Chimica organica nella nostra vita quotidiana. (9 marzo 2014). Quali sono gli usi degli esteri? Estratto da: gen2chemistassignment.weebly.com
- Quimicas.net (2018). Esempi di esteri. Estratto da: quimicas.net
- Paz María de Lourdes Cornejo Arteaga. Principali applicazioni degli esteri. Tratto da: uaeh.edu.mx
- Jim Clark. (Gennaio 2016). Presentazione degli esteri. Tratto da: chemguide.co.uk



Nessun utente ha ancora commentato questo articolo.