
Caratteristiche delle soluzioni tampone, preparazione, esempi

Il soluzioni tampone oppure i tamponi sono quelli che possono diminuire le variazioni di pH dovute agli ioni H.3O+ e OH-. In assenza di questi, alcuni sistemi (come quelli fisiologici) sono danneggiati, poiché i loro componenti sono molto sensibili ai cambiamenti improvvisi del pH.
Proprio come gli ammortizzatori delle auto riducono l'impatto causato dal loro movimento, i respingenti fanno lo stesso ma con l'acidità o la basicità della soluzione. Inoltre, i tamponi stabiliscono uno specifico intervallo di pH entro il quale sono efficienti..

Altrimenti, gli ioni H.3O+ acidificheranno la soluzione (il pH scende a valori inferiori a 6), portando di conseguenza una possibile alterazione della resa della reazione. Lo stesso esempio può essere applicato per valori di pH basici, cioè maggiori di 7.
Indice articolo
- 1 Caratteristiche
- 1.1 Composizione
- 1.2 Neutralizzano sia gli acidi che le basi
- 1.3 Efficienza
- 2 Preparazione
- 3 esempi
- 4 Riferimenti
Caratteristiche
Composizione
Sono essenzialmente composti da un acido (HA) o una base debole (B) e sali della loro base o acido coniugato. Di conseguenza, ci sono due tipi: tamponi acidi e tamponi alcalini..
I tamponi acidi corrispondono alla coppia HA / A-, dove- è la base coniugata dell'acido debole HA e interagisce con gli ioni, come Na+- per formare sali di sodio. In questo modo, la coppia rimane come HA / NaA, sebbene possano anche essere sali di potassio o di calcio.
Derivato dall'HA acido debole, tampona gli intervalli di pH acidi (inferiori a 7) secondo la seguente equazione:
HA + OH- => A- + HDueO
Tuttavia, essendo un acido debole, la sua base coniugata è parzialmente idrolizzata per rigenerare parte dell'HA consumato:
PER- + HDueO <=> HA + OH-
D'altra parte, i tamponi alcalini sono costituiti dalla coppia B / HB+, dove HB+ è l'acido coniugato della base debole. In generale, HB+ forma sali con ioni cloruro, lasciando la coppia come B / HBCl. Questi tamponi tamponano gli intervalli di pH basici (maggiori di 7):
B + H3O+ => HB+ + HDueO
E ancora, HB+ può essere parzialmente idrolizzato per rigenerare parte di B consumato:
HB+ + HDueO <=> B + H3O+
Neutralizzano sia gli acidi che le basi
Mentre i tamponi acidi tamponano il pH acido e tamponi alcalini il pH basico, entrambi possono reagire con gli ioni H.3O+ e OH- attraverso queste serie di equazioni chimiche:
PER- + H3O+ => HA + HDueO
HB+ + Oh- => B + HDueO
Quindi, nel caso della coppia HA / A-, HA reagisce con gli ioni OH-, mentre A- -la sua base coniugata- reagisce con l'H3O+. Per quanto riguarda la coppia B / HB+, B reagisce con gli ioni H.3O+, mentre HB+ -il suo acido coniugato- con l'OH-.
Ciò consente a entrambi i tamponi di neutralizzare sia le specie acide che quelle basiche. Il risultato di quanto sopra contro, ad esempio, l'aggiunta costante di moli di OH-, è la diminuzione della variazione di pH (ΔpH):
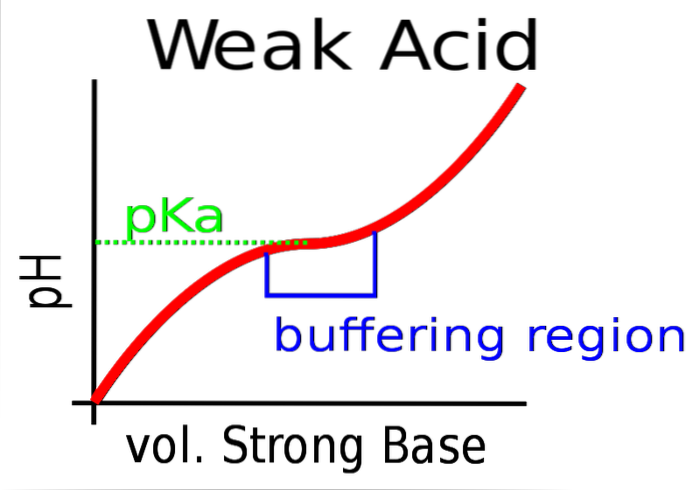
L'immagine in alto mostra il tamponamento del pH contro una base forte (donatore di OH-).
Inizialmente il pH è acido per la presenza di HA. Quando viene aggiunta la base forte, si formano le prime moli di A.- e il buffer inizia ad avere effetto.
Tuttavia, c'è un'area della curva in cui la pendenza è meno ripida; cioè dove lo smorzamento è più efficiente (riquadro bluastro).
Efficienza
Esistono diversi modi per comprendere il concetto di efficienza di smorzamento. Uno di questi è determinare la derivata seconda della curva pH rispetto al volume di base, risolvendo per V il valore minimo, che è Veq / 2.
Veq è il volume nel punto di equivalenza; questo è il volume di base necessario per neutralizzare tutto l'acido.
Un altro modo per capirlo è attraverso la famosa equazione di Henderson-Hasselbalch:
pH = pKper + log ([B] / [A])
Qui B indica la base, A l'acido e pKper è il logaritmo più piccolo della costante di acidità. Questa equazione si applica sia per la specie acida HA, sia per l'acido coniugato HB+.
Se [A] è molto grande rispetto a [B], log () assume un valore molto negativo, che viene sottratto dal pKper. Se invece [A] è molto piccolo rispetto a [B], il valore di log () assume un valore molto positivo, che si somma a pKper. Tuttavia, quando [A] = [B], log () è 0 e pH = pKper.
Cosa significa tutto quanto sopra? Che il ΔpH sarà maggiore negli estremi considerati per l'equazione, mentre sarà minimo con un pH pari al pKper; e come pKper è caratteristico di ogni acido, questo valore determina l'intervallo pKper± 1.
I valori di pH all'interno di questo intervallo sono quelli in cui il tampone è più efficiente..
Preparazione
Per preparare una soluzione tampone, è necessario tenere presenti i seguenti passaggi:
- Conoscere il pH richiesto e, quindi, quello che si desidera mantenere il più costante possibile durante la reazione o il processo.
- Conoscendo il pH, si cercano tutti gli acidi deboli, quelli il cui pKper è più vicino a questo valore.
- Dopo aver scelto la specie HA e calcolato la concentrazione del tampone (a seconda di quanta base o acido deve essere neutralizzato), viene pesata la quantità necessaria del suo sale di sodio..
Esempi
L'acido acetico ha un pKper di 4.75, CH3COOH; quindi, una miscela di determinate quantità di questo acido e acetato di sodio, CH3COONa, forma un tampone che tampona efficacemente nell'intervallo di pH (3,75-5,75).
Altri esempi di acidi monoprotici sono gli acidi benzoici (C.6H5COOH) e formico (HCOOH). Per ognuno di questi i loro valori pKper sono 4.18 e 3.68; pertanto, i loro intervalli di pH tampone più elevati sono (3,18-5,18) e (2,68-4,68).
D'altra parte, gli acidi poliprotici come il fosforico (H.3PO4) e carbonica (H.DueCO3) hanno tanti valori pKper come i protoni possono rilasciare. Pertanto, l'H3PO4 ha tre pKper (2.12, 7.21 e 12.67) e l'HDueCO3 ha due (6.352 e 10.329).
Se vuoi mantenere un pH di 3 in una soluzione, puoi scegliere tra HCOONa / HCOOH (pKper= 3,68) e NaHDuePO4/ H3PO4 (pKper= 2,12).
Il primo tampone, quello dell'acido formico, è più vicino a pH 3 rispetto al tampone dell'acido fosforico; quindi HCOONa / HCOOH tampona meglio a pH 3 rispetto a NaHDuePO4/ H3PO4.
Riferimenti
- Day, R. e Underwood, A. Chimica analitica quantitativa (quinto ed.). PEARSON Prentice Hall, p. 188-194.
- Avsar Aras. (20 aprile 2013). Mini ammortizzatori. Estratto il 9 maggio 2018 da: commons.wikimedia.org
- Wikipedia. (2018). Soluzione tampone. Estratto il 9 maggio 2018 da: en.wikipedia.org
- Assoc. Prof. Lubomir Makedonski, PhD. [Doc.]. Soluzioni tampone. Università di Medicina di Varna.
- Chem Collective. Tutorial sui buffer. Estratto il 9 maggio 2018 da: chemcollective.org
- askIITians. (2018). Soluzione tampone. Estratto il 9 maggio 2018 da: askiitians.com
- Quimicas.net (2018). Esempi di soluzioni tampone, tampone o tampone. Estratto il 9 maggio 2018 da: quimicas.net



Nessun utente ha ancora commentato questo articolo.