
Storia, proprietà, struttura, ottenimento, usi del selenio
Il selenio È un elemento chimico non metallico che appartiene al gruppo 16 della tavola periodica ed è rappresentato dal simbolo Se. Questo elemento ha proprietà intermedie tra lo zolfo e il tellurio, che fanno parte dello stesso gruppo.
Il selenio fu scoperto nel 1817 da Jöhs J. Berzelius e John G. Gahn, che durante la vaporizzazione della pirite osservarono un residuo rosso (immagine in basso). All'inizio l'hanno confuso con il tellurio, ma poi si sono resi conto che avevano a che fare con un nuovo elemento.

Berzelius chiamò il nuovo elemento selenio, in base al nome "selene" che significa "dea della luna". Il selenio è un oligoelemento essenziale per piante e animali, sebbene in alte concentrazioni sia un elemento tossico.
Il selenio ha tre principali forme allotropiche: rosso, nero e grigio. Quest'ultimo ha la proprietà di modificare la sua conduttanza elettrica a seconda dell'intensità della luce che lo irradia (fotoconduttore), per la quale ha avuto molte applicazioni.
Il selenio è ampiamente distribuito nella crosta terrestre, tuttavia i minerali che lo contengono non sono abbondanti, quindi non c'è estrazione di selenio.
È ottenuto principalmente come sottoprodotto del processo di raffinazione per elettrolisi del rame. Il selenio si accumula nel limo trovato all'anodo delle celle di elettrolisi.
Gli esseri umani possiedono circa 25 selenoproteine, alcune delle quali hanno un'azione antiossidante e controllano la generazione di radicali liberi. Inoltre, ci sono amminoacidi del selenio, come la selenometionina e la selenocisteina.
Indice articolo
- 1 Storia
- 1.1 Prima osservazione
- 1.2 Scoperta
- 1.3 Origine del suo nome
- 1.4 Sviluppare le tue applicazioni
- 2 Proprietà fisiche e chimiche
- 2.1 Aspetto
- 2.2 Peso atomico standard
- 2.3 Numero atomico (Z)
- 2.4 Punto di fusione
- 2.5 Punto di ebollizione
- 2.6 Densità
- 2.7 Calore di fusione
- 2.8 Calore di vaporizzazione
- 2.9 Capacità termica molare
- 2.10 numeri di ossidazione
- 2.11 Elettronegatività
- 2.12 Energia di ionizzazione
- 2.13 Ordine magnetico
- 2.14 Durezza
- 2.15 Isotopi
- 2.16 Allotropia
- 3 Reattività
- 3.1 Reazione con l'idrogeno
- 3.2 Reazione con l'ossigeno
- 3.3 Reazione con alogeni
- 3.4 Reazione con i metalli
- 3.5 Seleniti
- 3.6 Acidi
- 4 Struttura e configurazione elettronica
- 4.1 - Selenio e suoi legami
- 4.2 - Anelli o catene
- 4.3 - Allotropi
- 5 Dove trovare e produzione
- 5.1 Elettrolisi del rame
- 6 Ruolo biologico
- 6.1 Carenza
- 6.2 Cofattore enzimatico
- 6.3 Proteine e amminoacidi
- 7 Rischi
- 8 Usi
- 8.1 Cosmetici
- 8.2 Medici
- 8.3 Elettrolisi del manganese
- 8.4 Pigmento
- 8.5 Fotoconduttore
- 8.6 Cristalli
- 8.7 Vulcanizzazione
- 8.8 Leghe
- 8.9 Raddrizzatori
- 9 Riferimenti
Storia
Prima osservazione
L'alchimista Arnold de Villanova potrebbe aver osservato il selenio nel 1230. Si formò in medicina alla Sorbona di Parigi, ed era anche il dottore di papa Clemente V.
Villanova nel suo libro Rosarium Philosophorum descrive uno zolfo rosso o "zolfo rebeum" che era stato lasciato in una fornace dopo aver vaporizzato lo zolfo. Questo zolfo rosso potrebbe essere stato un allotropo del selenio.
Scoperta
Nel 1817, Jöhs Jakob Berzelius e John Gottlieb Gahn scoprirono il selenio in uno stabilimento chimico per la produzione di acido solforico, vicino a Gripsholm, in Svezia. La materia prima per produrre l'acido era la pirite, estratta da una miniera del Falun..
Berzelius fu colpito dall'esistenza di un residuo rosso rimasto nel contenitore di piombo dopo che lo zolfo era stato bruciato.
Inoltre, Berzelius e Gahn hanno osservato che il residuo rosso aveva un forte odore di rafano, simile a quello del tellurio. Ecco perché scrisse al suo amico Marect che credevano che il deposito osservato fosse un composto di tellurio..
Tuttavia, Berselius ha continuato ad analizzare il materiale depositato quando la pirite è stata incenerita e ha riconsiderato che nella miniera del Falun non era stato trovato alcun tellurio. Nel febbraio 1818 concluse di aver scoperto un nuovo elemento.
Origine del suo nome
Berzelius ha sottolineato che il nuovo elemento era una combinazione di zolfo e tellurio, e che la somiglianza del tellurio al nuovo elemento gli aveva dato l'opportunità di nominare la nuova sostanza selenio..
Berzelius ha spiegato che "tellus" significa dea della terra. Martin Klaport nel 1799 diede questo nome al tellurio e scrisse: “Nessun singolo elemento è chiamato così. Doveva essere fatto! ".
A causa della somiglianza del tellurio con la nuova sostanza, Berzelius lo chiamò con la parola selenio, derivata dalla parola greca "selene" che significa "dea della luna"..
Sviluppo delle tue applicazioni
Nel 1873 Willoughby Smith scoprì che la conduttività elettrica del selenio dipendeva dalla luce che lo irradiava. Questa proprietà ha permesso al selenio di avere numerose applicazioni.
Alexander Graham Bell nel 1979 ha usato il selenio nel suo fotofono. Il selenio produce una corrente elettrica proporzionale all'intensità della luce che lo illumina, essendo utilizzato in esposimetri, meccanismi di sicurezza per apertura e chiusura porte, ecc..
L'uso dei raddrizzatori al selenio nell'elettronica iniziò negli anni '30, con numerose applicazioni commerciali. Negli anni '70 è stato soppiantato nei raddrizzatori dal silicio.
Nel 1957 si scoprì che il selenio era un elemento essenziale per la vita dei mammiferi, poiché era presente negli enzimi che proteggono dall'ossigeno reattivo e dai radicali liberi. Inoltre, è stata scoperta l'esistenza di amminoacidi come la selenometionina.
Proprietà fisiche e chimiche
Aspetto
Poiché esistono diversi allotropi per il selenio, il suo aspetto fisico varia. Di solito si presenta come un solido rossastro sotto forma di polvere.
Peso atomico standard
78.971 u
Numero atomico (Z)
3. 4
Punto di fusione
221 ºC
Punto di ebollizione
685 ºC
Densità
La densità del selenio varia a seconda di quale allotropo o polimorfo viene considerato. Alcune delle sue densità determinate a temperatura ambiente sono:
Grigio: 4.819 g / cm3
Alfa: 4,39 g / cm3
Vitreo: 4,28 g / cm3
Stato liquido (punto di fusione): 3,99 g / cm3
Calore di fusione
Grigio: 6,69 kJ / mol
Calore di vaporizzazione
95,48 kJ / mol
Capacità termica molare
25,363 J / (mol K)
Numeri di ossidazione
Il selenio può legarsi nei suoi composti manifestando i seguenti numeri o stati di ossidazione: -2, -1, +1, +2, +3, +4, +5, +6. Tra tutti i più importanti sono -2 (SeDue-), +4 (Se4+) e +6 (Se6+).
Ad esempio, nel SeODue il selenio ha un numero di ossidazione di +4; cioè, si presume l'esistenza del catione Se4+ (Lo so4+ODueDue-). Allo stesso modo con SeO3 il selenio ha un numero di ossidazione di +6 (Se6+O3Due-).
In seleniuro di idrogeno, H.DueSe, il selenio ha un numero di ossidazione di -2; cioè, ancora una volta, si presume l'esistenza dello ione o anione SeDue- (H.Due+lo soDue-). Questo perché il selenio è più elettronegativo dell'idrogeno..
Elettronegatività
2,55 della scala Pauling.
Energia ionizzata
-Primo: 941 kJ / mol.
-Secondo: 2.045 kJ / mol.
-Terzo: 2.973,7 kJ / mol.
Ordine magnetico
Diamagnetico.
Durezza
2.0 sulla scala di Mohs.
Isotopi
Esistono cinque isotopi naturali e stabili del selenio, che vengono mostrati di seguito con le rispettive abbondanze:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Allotropia

Il selenio preparato nelle reazioni chimiche è una polvere amorfa rosso mattone, che una volta sciolta rapidamente dà origine alla forma nero vitreo, simile ai grani del rosario (immagine in alto). Il selenio nero è un solido fragile e lucido.
Inoltre, il selenio nero è leggermente solubile in solfuro di carbonio. Quando questa soluzione viene riscaldata a 180 ºC, precipita il selenio grigio, il suo allotropo più stabile e denso..
Il selenio grigio è resistente all'ossidazione ed è inerte all'azione degli acidi non ossidanti. La proprietà principale di questo selenio è la sua fotoconduttività. Quando è illuminato, la sua conduttività elettrica aumenta di un fattore da 10 a 15 volte.
Reattività
Il selenio nei suoi composti esiste negli stati di ossidazione -2, +4 e +6. Mostra una chiara tendenza a formare acidi negli stati di ossidazione più elevati. I composti che hanno selenio con stato di ossidazione -2 sono chiamati seleniuri (SeDue-).
Reazione con l'idrogeno
Il selenio reagisce con l'idrogeno per formare il seleniuro di idrogeno (H.DueSe), un gas incolore, infiammabile e maleodorante.
Reazione con l'ossigeno
Il selenio brucia emettendo una fiamma blu e formando biossido di selenio:
lo so8 (s) + 8 ODue => 8 SeODue (S)
L'ossido di selenio è una sostanza polimerica solida, bianca. La sua idratazione produce acido selenio (H.DueSeO3). Anche il selenio forma triossido di selenio (SeO3), analogo allo zolfo (SO3).
Reazione con alogeni
Il selenio reagisce con il fluoro per formare esafluoruro di selenio:
lo so8 (i) + 24 F.Due (g) => 8 SeF6 (l)
Il selenio reagisce con il cloro e il bromo per formare dicloruro di disilenio e dibromuro, rispettivamente:
lo so8 (i) + 4 ClDue => 4 SeDueClDue
lo so8 (s) + 4 BrDue => 4 SeDueBrDue
Il selenio può anche formare SeF4 e SeCl4.
D'altra parte, il selenio forma composti in cui un atomo di selenio si unisce con uno di alogeno e un altro di ossigeno. Un esempio importante è l'ossicloruro di selenio (SeODueClDue), con selenio allo stato di ossidazione +6, un solvente estremamente potente.
Reazione con i metalli
Il selenio reagisce con i metalli per formare seleniuri di alluminio, cadmio e sodio. L'equazione chimica seguente corrisponde a quella per la formazione del seleniuro di alluminio:
3 Se8 + 16 Al => 8 AlDuelo so3
Seleniti
Il selenio forma sali noti come seleniti; ad esempio: selenite d'argento (AgDueSeO3) e selenito di sodio (NaDueSeO3). Questo nome è stato usato, in un contesto letterario, per riferirsi agli abitanti della Luna: i Seleniti.
Acidi
L'acido più importante nel selenio è l'acido selenico (H.DueSeO4). È forte come l'acido solforico e si riduce più facilmente.
Struttura e configurazione elettronica
- Selenio e suoi legami
Il selenio ha sei elettroni di valenza, motivo per cui si trova nel gruppo 16, lo stesso dell'ossigeno e dello zolfo. Questi sei elettroni si trovano negli orbitali 4s e 4p, in base alla loro configurazione elettronica:
[Ar] 3d10 4sDue 4p4
Ha quindi bisogno, come lo zolfo, di formare due legami covalenti per completare il suo ottetto di valenza; sebbene abbia la disponibilità dei suoi orbitali 4d per legarsi con più di due atomi. Pertanto, tre atomi di selenio si uniscono e formano due legami covalenti: Se-Se-Se.
Il selenio con la sua massa atomica più elevata ha una naturale tendenza a formare strutture governate da legami covalenti; invece di essere organizzato come molecole biatomiche SeDue, Se = Se, analogo a ODue, O = O.
- Anelli o catene
Tra le strutture molecolari che adottano gli atomi di selenio, se ne possono citare in termini generali due: anelli o catene. Si noti che nel caso ipotetico di Se3, gli atomi di Se alle estremità richiedono ancora elettroni; quindi, devono essere legati ad altri atomi, in successione, fino a quando la catena può essere chiusa in un anello.
Gli anelli più comuni sono gli anelli a otto membri o gli atomi di selenio:8 (una corona di selenite). Perché otto? Perché più piccolo è l'anello, maggiore sarà lo stress che subirà; cioè, gli angoli dei loro legami deviano dai valori naturali fissati dalle loro ibridazioni sp3 (simile a quello dei cicloalcani).
Poiché ci sono otto atomi, la separazione tra gli atomi di Se-Se è sufficiente in modo che i loro legami siano "rilassati" e non "piegati"; sebbene l'angolo delle sue maglie sia 105,7º e non 109,5º. D'altra parte, potrebbero esserci anelli più piccoli:6 e7.
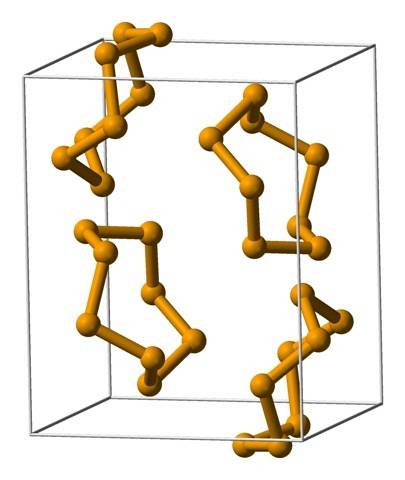
L'immagine in alto mostra le unità Se ring.8. Notare la somiglianza che hanno con le corone di zolfo; solo che sono più grandi e più pesanti.
Oltre agli anelli, gli atomi di selenio possono anche essere disposti in catene elicoidali (si pensi alle scale a chiocciola):
Alle sue estremità possono esserci doppi legami terminali (-Se = Se), o anelli Se8.
- Allotropi
Tenendo conto che possono esserci anelli elicoidali o catene di selenio, e che le loro dimensioni possono variare anche a seconda del numero di atomi che contengono, allora è evidente che c'è più di un allotropo per questo elemento; cioè, solidi di selenio puro ma con diverse strutture molecolari.
Selenio rosso
Tra gli allotropi più importanti del selenio abbiamo il rosso, che può apparire come una polvere amorfa, o come cristalli monoclina e polimorfici (vedi immagine di Se8).
Nel selenio rosso amorfo le strutture sono disordinate, senza schemi apparenti; mentre nella lente, gli anelli stabiliscono una struttura monoclina. Il selenio cristallino rosso è polimorfico, ha tre fasi: α, β e γ, che differiscono per la loro densità..
Selenio nero
Anche la struttura del selenio nero è costituita da anelli; ma non di otto membri, ma di molti di più, raggiungendo anelli di mille atomi (Se1000). Si dice poi che la sua struttura sia complessa e costituita da anelli polimerici; alcuni più grandi o più piccoli di altri.
Poiché esistono anelli polimerici di diverse dimensioni, è difficile aspettarsi che stabiliscano un ordine strutturale; quindi il selenio nero è anche amorfo, ma in contrasto con la polvere rossastra menzionata sopra, ha una consistenza vetrosa, sebbene sia fragile.
Selenio grigio
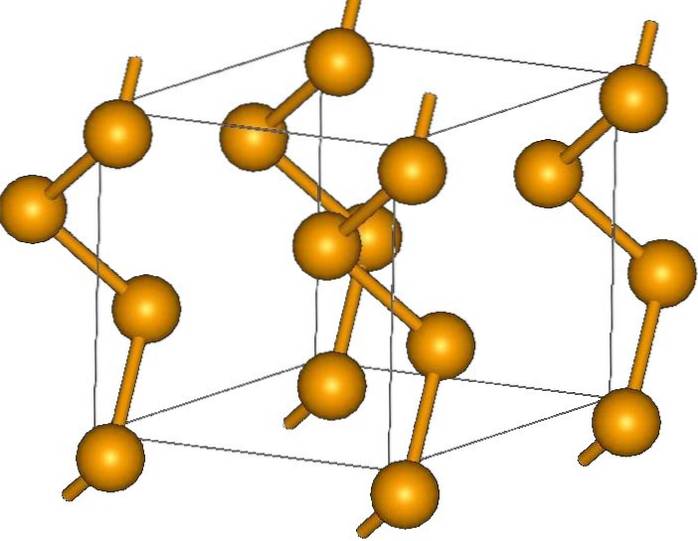
E infine, degli allotropi più semplici del selenio è il grigio, che spicca sugli altri in quanto è il più stabile in condizioni normali, e ha anche un aspetto metallico..
I suoi cristalli possono essere esagonali o trigonali, stabiliti dalle forze di dispersione di Londra tra le sue catene elicoidali polimeriche (immagine in alto). L'angolo dei loro legami è 130,1º, che indica una deviazione positiva dall'ambiente tetraedrico (con angoli di 109,5º)..
Ecco perché le catene elicoidali di selenio danno l'impressione di essere "aperte". A titolo di chiarimento, in questa struttura gli atomi sono uno di fronte all'altro, quindi in teoria ci deve essere una maggiore sovrapposizione dei loro orbitali per creare bande di conduzione.
Il calore con l'aumento delle vibrazioni molecolari danneggia queste bande quando le catene si disordinano; mentre l'energia di un fotone influenza direttamente gli elettroni, eccitandoli e promuovendone le transazioni. Da questo punto di vista, è “facile” immaginare la fotoconduttività del selenio grigio..
Dove si trova e produzione
Sebbene ampiamente distribuito, il selenio è un elemento raro. Si trova nel suo stato nativo associato a zolfo e minerali come eucairite (CuAgSe), claustalite (PbSe), naumanite (AgDueSe) e crookesite [(CuTiAg)DueLo so].
Il selenio si trova come un'impurità che sostituisce lo zolfo in una piccola porzione dei minerali solforosi dei metalli; come rame, piombo, argento, ecc..
Ci sono terreni in cui esiste il selenio nella forma solubile di selenati. Questi vengono trasportati dall'acqua piovana ai fiumi e da lì all'oceano.
Alcune piante sono in grado di assorbire e concentrare il selenio. Ad esempio, una tazza di noci del Brasile contiene 544 µg di selenio, una quantità che equivale al 777% della quantità giornaliera raccomandata di selenio..
Negli esseri viventi, il selenio si trova in alcuni amminoacidi, come: selenometionina, selenocisteina e metilselenocisteina. La selenocisteina e la selenite sono ridotte a seleniuro di idrogeno.
Elettrolisi del rame
Non c'è estrazione del selenio. La maggior parte è ottenuta come sottoprodotto del processo di raffinazione per elettrolisi del rame, trovandosi nel limo che si accumula all'anodo..
Il primo passo è la produzione di biossido di selenio. Per questo, il limo anodico viene trattato con carbonato di sodio per produrre la sua ossidazione. Quindi si aggiunge acqua all'ossido di selenio e si acidifica per formare acido di selenio..
Infine, l'acido selenio viene trattato con anidride solforosa per ridurlo e ottenere selenio elementare..
In un altro metodo nella miscela di limo e fango formato nella produzione di acido solforico, si ottiene un selenio rosso impuro che si dissolve in acido solforico..
Si formano quindi acido selenico e acido selenico. Questo acido selenio riceve lo stesso trattamento del metodo precedente.
Il cloro, che agisce sui seleniuri metallici, può essere utilizzato anche per produrre composti volatili di selenio clorurato; come ad esempio: SeDueClDue, SeCl4, SeClDue e SeOClDue.
Questi composti, in un processo effettuato in acqua, vengono convertiti in acido selenio, che viene trattato con anidride solforosa per rilasciare il selenio..
Ruolo biologico
Carenza
Il selenio è un oligoelemento essenziale per piante e animali, la cui carenza nell'uomo ha causato gravi disturbi come il morbo di Keshan; una malattia caratterizzata da un danno al miocardio.
Inoltre, la carenza di selenio è associata all'infertilità maschile e può svolgere un ruolo nella malattia di Kashin-Beck, un tipo di artrosi. Inoltre, è stata osservata una carenza di selenio nell'artrite reumatoide.
Cofattore enzimatico
Il selenio è un componente di enzimi ad azione antiossidante, come il glutatione perossidasi e la tioredossina reduttasi che agiscono per eliminare le sostanze con ossigeno reattivo..
Inoltre, il selenio è un cofattore delle deiodinasi dell'ormone tiroideo. Questi enzimi sono importanti per regolare il funzionamento degli ormoni tiroidei..
L'uso del selenio è stato segnalato nel trattamento della malattia di Hasimoto, una malattia autoimmune con formazione di anticorpi contro le cellule tiroidee.
Il selenio è stato anche utilizzato per ridurre gli effetti tossici del mercurio, poiché alcune delle sue azioni sono esercitate su enzimi antiossidanti dipendenti dal selenio.
Proteine e amminoacidi
L'uomo possiede circa 25 selenoproteine che esercitano un'azione antiossidante per la protezione dallo stress ossidativo, avviata da un eccesso di specie reattive dell'ossigeno (ROS) e specie reattive dell'azoto (NOS)..
Nell'uomo è stata rilevata la presenza degli aminoacidi selenometiocina e selenocisteina. La selenometionina è utilizzata come integratore alimentare nel trattamento degli stati di carenza di selenio.
Rischi
Un'elevata concentrazione corporea di selenio può avere numerosi effetti nocivi sulla salute, a partire da capelli fragili e unghie fragili, a eruzioni cutanee, calore, edema della pelle e dolore intenso.
Quando si tratta il selenio a contatto con gli occhi, le persone possono avvertire bruciore, irritazione e lacrimazione. Nel frattempo, l'esposizione prolungata al fumo ad alto contenuto di selenio può causare edema polmonare, alito d'aglio e bronchite..
Inoltre, la persona può manifestare polmonite, nausea, brividi, febbre, mal di gola, diarrea ed epatomegalia..
Il selenio può interagire con altri medicinali e integratori alimentari, come antiacidi, farmaci antineoplastici, corticosteroidi, niacina e pillole anticoncezionali..
Il selenio è stato associato ad un aumentato rischio di cancro della pelle. Uno studio del National Cancer Institute ha rilevato che gli uomini con un livello corporeo elevato di selenio avevano il doppio delle probabilità di soffrire di cancro alla prostata aggressivo.
Uno studio indica che l'assunzione giornaliera di 200 µg di selenio aumenta del 50% la possibilità di sviluppare il diabete di tipo II.
Applicazioni
Cosmetici
Il solfuro di selenio è utilizzato nel trattamento della seborrea, nonché dei capelli grassi o con forfora.
Medici
È usato come medicina alternativa nel trattamento della malattia di Hasimoto, una malattia autoimmune della tiroide.
Il selenio riduce la tossicità del mercurio, una delle sue attività tossiche è esercitata sugli enzimi disossidanti, che utilizzano il selenio come cofattore.
Elettrolisi del manganese
L'utilizzo dell'ossido di selenio nell'elettrolisi del manganese riduce notevolmente i costi della tecnica, poiché riduce il consumo di elettricità.
Pigmento
Il selenio è usato come pigmento in vernici, plastica, ceramica e vetro. A seconda del selenio utilizzato, il colore del vetro varia dal rosso intenso all'arancio chiaro..
Fotoconduttivo
A causa della proprietà del selenio grigio di modificare la sua conducibilità elettrica in funzione dell'intensità della luce che lo irradia, il selenio è stato utilizzato in fotocopiatrici, fotocellule, fotometri e celle solari.
L'uso del selenio nelle fotocopiatrici è stata una delle principali applicazioni del selenio; ma la comparsa di fotoconduttori organici ha diminuito il loro utilizzo.
Cristalli
Il selenio viene utilizzato per lo scolorimento dei vetri, a causa della presenza del ferro che produce una colorazione verde o gialla. Inoltre permette una colorazione rossa del vetro, a seconda dell'uso che si vuole dargli..
Vulcanizzazione
Il selenio dietilditiocarbonato è usato come agente vulcanizzante nei prodotti in gomma.
Leghe
Il selenio viene utilizzato in combinazione con il bismuto in ottone per sostituire il piombo; Elemento molto tossico che ha diminuito il suo utilizzo a causa delle raccomandazioni delle organizzazioni sanitarie.
Il selenio viene aggiunto in basse concentrazioni all'acciaio e alle leghe di rame per migliorare l'usabilità di questi metalli..
Raddrizzatori
I raddrizzatori al selenio iniziarono ad essere utilizzati nel 1933 fino agli anni '70, quando furono sostituiti dal silicio a causa del suo basso costo e della qualità superiore..
Riferimenti
- Royal Australian Chemical Institute. (2011). Selenio. [PDF]. Estratto da: raci.org.au
- Wikipedia. (2019). Selenio. Estratto da: en.wikipedia.org
- Sato Kentaro. (s.f.). Nuovi allotropi degli elementi del gruppo principale. [PDF]. Estratto da: tcichemicals.com
- Dottor Dough Stewart. (2019). Fatti dell'elemento selenio. Chemicool. Estratto da: chemicool.com
- Robert C. Brasted. (28 agosto 2019). Selenio. Encyclopædia Britannica. Estratto da: britannica.com
- Marques Miguel. (s.f.). Selenio. Estratto da: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (03 luglio 2019). Fatti sul selenio. Estratto da: thoughtco.com
- Lenntech B. V. (2019). Tavola periodica: selenio. Estratto da: lenntech.com
- Tinggi U. (2008). Selenio: il suo ruolo come antiossidante nella salute umana. Salute ambientale e medicina preventiva, 13(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Ufficio degli integratori alimentari. (9 luglio 2019). Selenio: scheda informativa per professionisti della salute. Istituto Superiore di Sanità. Estratto da: ods.od.nih.gov


Nessun utente ha ancora commentato questo articolo.