
Storia, descrizione e conclusioni dell'esperimento di Rutherford
Il Esperimento di Rutherford, effettuato tra il 1908 e il 1913, consisteva nel bombardare una sottile lamina d'oro di 0.0004 mm di spessore con particelle alfa e analizzare il pattern di dispersione che queste particelle lasciavano su uno schermo fluorescente.
Rutherford condusse infatti numerosi esperimenti, affinando sempre di più i dettagli. Dopo aver analizzato attentamente i risultati, sono emerse due conclusioni molto importanti:
-La carica positiva dell'atomo è concentrata in una regione chiamata nucleo.
-Questo nucleo atomico è incredibilmente piccolo rispetto alle dimensioni dell'atomo.
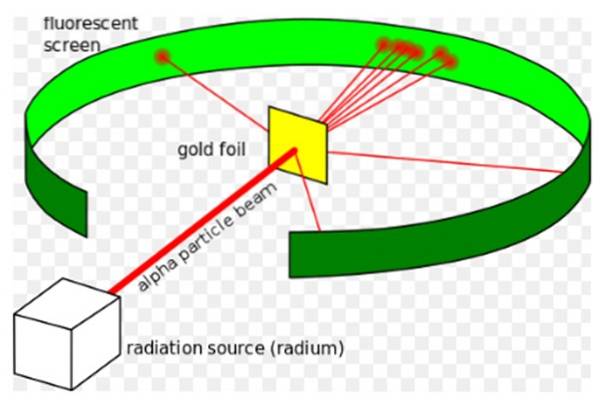
Ernest Rutherford (1871-1937) era un fisico nato in Nuova Zelanda il cui campo di interesse era la radioattività e la natura della materia. La radioattività era un fenomeno recente quando Rutherford iniziò i suoi esperimenti, era stata scoperta da Henri Becquerel nel 1896.
Nel 1907 Rutherford andò all'Università di Manchester in Inghilterra per studiare la struttura dell'atomo, usando queste particelle alfa come sonde per scrutare all'interno di una struttura così minuscola. I fisici Hans Geiger ed Ernest Marsden lo hanno accompagnato nel compito..
Speravano di vedere come una particella alfa, che è un atomo di elio doppiamente ionizzato, avrebbe interagito con un singolo atomo d'oro, per garantire che qualsiasi deviazione subita fosse dovuta esclusivamente alla forza elettrica..
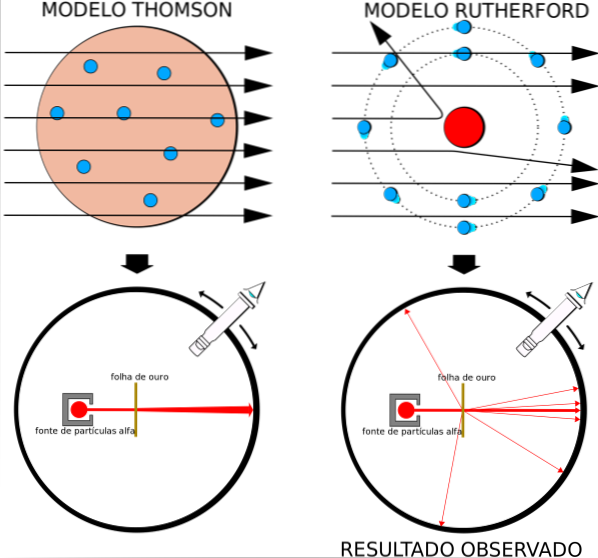
Tuttavia, la maggior parte delle particelle alfa è passata attraverso la lamina d'oro con solo una leggera deviazione..
Questo fatto era in totale accordo con il modello atomico di Thomson, tuttavia, con sorpresa dei ricercatori, una piccola percentuale delle particelle alfa ha subito una deviazione piuttosto notevole..
E una percentuale ancora più piccola di particelle tornerebbe indietro, rimbalzando completamente indietro. A cosa erano dovuti questi risultati inaspettati?
Indice articolo
- 1 Descrizione e conclusioni dell'esperimento
- 1.1 Conclusioni
- 2 Influenze sul modello dell'atomo
- 2.1 Svantaggi del modello Rutherford
- 2.2 Il protone e il neutrone
- 3 Com'è un modello in scala dell'atomo di idrogeno?
- 4 Il modello atomico oggi
- 5 Riferimenti
Descrizione e conclusioni dell'esperimento
In effetti, le particelle alfa che Rutherford usò come sonda sono nuclei di elio, e all'epoca si sapeva solo che queste particelle erano caricate positivamente. Oggi è noto che le particelle alfa sono composte da due protoni e due neutroni..
Le particelle alfa e le particelle beta erano state identificate da Rutherford come due diversi tipi di radiazioni dall'uranio. Le particelle alfa, molto più massicce dell'elettrone, hanno una carica elettrica positiva, mentre le particelle beta possono essere elettroni o positroni..
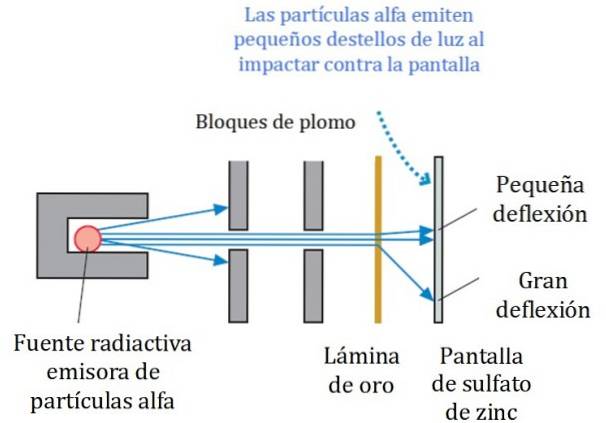
Uno schema semplificato dell'esperimento è mostrato nella Figura 2. Il fascio di particelle alfa proviene da una sorgente radioattiva. Geiger e Marsden hanno utilizzato il gas radon come emettitore.
I blocchi di piombo sono stati utilizzati per dirigere la radiazione verso la lamina d'oro e impedire che andasse direttamente allo schermo fluorescente. Il piombo è un materiale che assorbe le radiazioni.
Il fascio così diretto è stato quindi fatto urtare su una sottile lamina d'oro e la maggior parte delle particelle ha continuato il proprio percorso verso lo schermo fluorescente al solfato di zinco, dove hanno lasciato una piccola traccia di luce. Geiger era incaricato di contarli uno per uno, anche se in seguito hanno progettato un dispositivo che lo faceva.
Il fatto che alcune particelle abbiano subito una piccola deflessione non ha sorpreso Rutherford, Geiger e Marsden. Dopotutto, ci sono cariche positive e negative sull'atomo che esercitano forze sulle particelle alfa, ma poiché l'atomo è neutro, cosa che già conoscevano, le deviazioni dovevano essere piccole..
La sorpresa dell'esperimento è che alcune particelle positive sono state rimbalzate quasi direttamente all'indietro..
Conclusioni
Circa 1 su 8000 particelle alfa sono state deviate ad angoli maggiori di 90º. Pochi, ma sufficienti per mettere in discussione alcune cose.
Il modello atomico in voga era quello del budino all'uvetta di Thomson, l'ex professore di Rutherford al Cavendish Laboratory, ma Rutherford si chiedeva se l'idea di un atomo senza nucleo e con elettroni incorporati come uva passa, fosse corretta..
Perché risulta che queste grandi deviazioni delle particelle alfa, e il fatto che alcune siano in grado di ritornare, possono essere spiegate solo se un atomo ha un nucleo piccolo, pesante e positivo. Rutherford presumeva che solo le forze elettriche attraenti e repulsive, come indicato dalla legge di Coulomb, fossero responsabili di qualsiasi deviazione..
Quando alcune delle particelle alfa si avvicinano direttamente a questo nucleo e poiché la forza elettrica varia con il quadrato inverso della distanza, avvertono una repulsione che causa loro la dispersione ad ampio angolo o la deflessione all'indietro..
A dire il vero, Geiger e Marsden hanno sperimentato bombardando fogli di metalli diversi, non solo oro, sebbene questo metallo fosse il più appropriato per la sua malleabilità, per creare fogli molto sottili..
Ottenendo risultati simili, Rutherford era convinto che la carica positiva nell'atomo dovesse essere situata nel nucleo e non dispersa in tutto il suo volume, come postulato da Thomson nel suo modello..
D'altra parte, poiché la stragrande maggioranza delle particelle alfa è passata senza deviazioni, il nucleo doveva essere molto, molto piccolo rispetto alla dimensione atomica. Tuttavia, questo nucleo doveva concentrare la maggior parte della massa dell'atomo.
Influenze sul modello dell'atomo
I risultati hanno notevolmente sorpreso Rutherford, che ha dichiarato in una conferenza a Cambridge: “… È come quando spari una palla di cannone da 15 pollici contro un foglio di carta velina e il proiettile rimbalza dritto su di te e ti colpisce.".
Poiché questi risultati non potevano essere spiegati dal modello atomico di Thomson, Rutherford propose che l'atomo fosse costituito da un nucleo, molto piccolo, molto massiccio e caricato positivamente. Gli elettroni rimasero in orbita intorno a lui, come un sistema solare in miniatura.
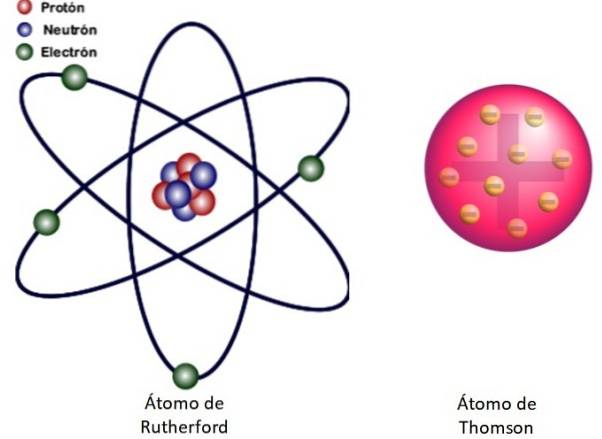
Questo è ciò che riguarda il modello nucleare dell'atomo mostrato nella Figura 3 a sinistra. Poiché anche gli elettroni sono molto, molto piccoli, risulta che l'atomo è quasi tutto…. vuoto! Pertanto, la maggior parte delle particelle alfa passano attraverso il foglio appena deviate..
E l'analogia con un sistema solare in miniatura è molto accurata. Il nucleo atomico svolge il ruolo del Sole, contenendo quasi tutta la massa più la carica positiva. Gli elettroni orbitano intorno a loro come pianeti e trasportano una carica negativa. L'assemblaggio è elettricamente neutro.
Riguardo alla distribuzione degli elettroni nell'atomo, l'esperimento di Rutherford non ha mostrato nulla. Si potrebbe pensare che le particelle alfa abbiano qualche interazione con loro, ma la massa degli elettroni è troppo piccola e non sono stati in grado di deviare in modo significativo le particelle..
Svantaggi del modello Rutherford
Un problema con questo modello atomico era proprio il comportamento degli elettroni.
Se questi non fossero statici, ma orbitanti attorno al nucleo atomico in orbite circolari o ellittiche, diretti dall'attrazione elettrica, finirebbero per cadere verso il nucleo..
Questo perché gli elettroni accelerati perdono energia e, se ciò accade, sarebbe il collasso dell'atomo e della materia..
Fortunatamente questo non è ciò che accade. C'è una sorta di stabilità dinamica che impedisce il collasso. Il modello atomico successivo, dopo quello di Rutherford, fu quello di Bohr, che diede alcune risposte sul motivo per cui non si verifica il collasso atomico.
Il protone e il neutrone
Rutherford ha continuato a fare esperimenti di dispersione. Tra il 1917 e il 1918, lui e il suo assistente William Kay scelsero di bombardare gli atomi di azoto gassoso con le particelle alfa altamente energetiche del bismuto-214..
È stato di nuovo sorpreso quando ha rilevato i nuclei di idrogeno. Questa è l'equazione della reazione, la prima trasmutazione nucleare artificiale mai ottenuta:
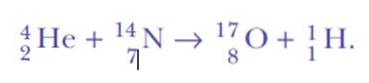
La risposta è stata: dallo stesso azoto. Rutherford aveva assegnato all'idrogeno il numero atomico 1, perché è l'elemento più semplice di tutti: un nucleo positivo e un elettrone negativo.
Rutherford aveva trovato una particella fondamentale che chiamava protone, un nome derivato dalla parola greca per Primo. In questo modo, il protone è un costituente essenziale di ogni nucleo atomico..
Più tardi, intorno al 1920, Rutherford propose che dovesse esserci una particella neutra con una massa molto simile a quella del protone. Ha chiamato questa particella neutrone e fa parte di quasi tutti gli atomi conosciuti. Il fisico James Chadwick lo identificò finalmente nel 1932.
Com'è un modello in scala dell'atomo di idrogeno?
L'atomo di idrogeno è, come abbiamo detto, il più semplice di tutti. Tuttavia, non è stato facile sviluppare un modello per questo atomo..
Le scoperte successive hanno dato origine alla fisica quantistica e a un'intera teoria che descrive i fenomeni su scala atomica. Durante questo processo, anche il modello atomico si è evoluto. Ma diamo un'occhiata alla questione delle taglie:
L'atomo di idrogeno ha un nucleo costituito da un protone (positivo) e ha un singolo elettrone (negativo).
Il raggio dell'atomo di idrogeno è stato stimato in 2,1 x 10-10 m, mentre quella del protone è 0,85 x 10 -quindici mo 0,85 femtometri. Il nome di questa piccola unità è dovuto a Enrico Fermi ed è molto utilizzato quando si lavora su questa scala.
Ebbene, il quoziente tra il raggio dell'atomo e quello del nucleo è dell'ordine di 105 m, cioè l'atomo è 100.000 volte più grande del nucleo!!.
Tuttavia, si deve tener conto che nel modello contemporaneo, basato sulla Meccanica Quantistica, l'elettrone avvolge il nucleo in una sorta di nuvola chiamata orbitale (un orbitale non è un'orbita) e l'elettrone, su scala atomica, non è puntuale.
Se l'atomo di idrogeno fosse ingrandito - immaginativamente - alle dimensioni di un campo da calcio, il nucleo composto da un protone positivo avrebbe le dimensioni di una formica al centro del campo, mentre l'elettrone negativo sarebbe come una specie di fantasma , sparsi in tutto il campo e che circondano il nucleo positivo.
Il modello atomico oggi
Questo modello atomico di "tipo planetario" è molto radicato ed è l'immagine che la maggior parte delle persone ha dell'atomo, poiché è molto facile da visualizzare. tuttavia, Non è il modello accettato oggi in campo scientifico.
I modelli atomici contemporanei sono basati sulla meccanica quantistica. Sottolinea che l'elettrone nell'atomo non è un punto caricato negativamente che segue orbite precise, come quelle immaginate da Rutherford..
Piuttosto, l'elettrone lo è sparpagliato in zone, intorno al nucleo positivo, chiamate orbitali atomici. Da lui possiamo sapere probabilità essere in uno stato o nell'altro.
Nonostante ciò, il modello di Rutherford ha rappresentato un enorme progresso nella comprensione della struttura interna dell'atomo. E ha aperto la strada a più ricercatori per continuare a perfezionarlo..
Riferimenti
- Andriessen, M. 2001. Corso HSC. Fisica 2. Jacaranda HSC Science.
- Arfken, G. 1984. Università di Fisica. Stampa accademica.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Fisica OpenLab. L'esperimento Rutherford-Geiger-Marsden. Estratto da: physicsopenlab.org.
- Rex, A. 2011. Fondamenti di fisica. Pearson.
- Tyson, T. 2013. The Rutherford Scattering Experiment. Estratto da: 122.physics.ucdavis.edu.
- Xaktly. Gli esperimenti di Rutherford. Estratto da: xaktly.com.
- Wikipedia. L'esperimento di Rutherford. Estratto da: es.wikipedia.org.



Nessun utente ha ancora commentato questo articolo.