
Seconda legge della termodinamica formule, equazioni, esempi
Il Seconda legge della termodinamica ha varie forme di espressione. Uno di loro afferma che nessun motore termico è in grado di convertire completamente tutta l'energia che assorbe in lavoro utilizzabile (formulazione di Kelvin-Planck). Un altro modo per affermarlo è dire che i processi reali avvengono in un senso tale che la qualità dell'energia è inferiore perché il entropia tende ad aumentare.
Questa legge, nota anche come secondo principio della termodinamica, è stata espressa in modi diversi nel tempo, dall'inizio del XIX secolo ad oggi, sebbene le sue origini risalgano alla creazione delle prime macchine a vapore in Inghilterra., All'inizio del il XVIII secolo.

Ma sebbene sia espressa in molti modi, l'idea che la materia tende a diventare disordinata e che nessun processo è efficiente al 100%, poiché le perdite esisteranno sempre..
Tutti i sistemi termodinamici aderiscono a questo principio, a partire dall'universo stesso fino alla tazza di caffè mattutina che attende tranquillamente sulla tavola scambiando calore con l'ambiente..
Il caffè si raffredda con il passare del tempo, fino a trovarsi in equilibrio termico con l'ambiente, quindi sarebbe molto sorprendente se un giorno accadesse il contrario e l'ambiente si raffreddasse mentre il caffè si riscaldava. È improbabile che accada, qualcuno dirà impossibile, ma immaginalo per avere un'idea del senso in cui le cose accadono spontaneamente.
In un altro esempio, se facciamo scorrere un libro sulla superficie di un tavolo, alla fine si fermerà, perché la sua energia cinetica andrà persa sotto forma di calore a causa dell'attrito..
La prima e la seconda legge della termodinamica furono stabilite intorno al 1850, grazie a scienziati come Lord Kelvin - ideatore del termine "termodinamica" -, William Rankine - autore del primo testo formale sulla termodinamica - e Rudolph Clausius..
Indice articolo
- 1 Formule ed equazioni
- 1.1 Processi reversibili e irreversibili
- 2 Applicazioni
- 2.1 motore di Carnot
- 2.2 Metabolismo umano
- 3 esempi
- 4 Esercizi risolti
- 4.1 Esercizio 1
- 4.2 Esercizio 2
- 4.3 Esercizio 3
- 5 Riferimenti
Formule ed equazioni
L'entropia - menzionata all'inizio - ci aiuta a stabilire il senso in cui le cose accadono. Torniamo all'esempio dei corpi in contatto termico.
Quando due oggetti a temperature diverse entrano in contatto e alla fine dopo un po 'raggiungono l'equilibrio termico, sono spinti ad esso dal fatto che l'entropia raggiunge il suo massimo, quando la temperatura di entrambi è la stessa.
Indicare l'entropia come S, il cambiamento di entropia ΔS di un sistema è dato da:

Il cambiamento di entropia ΔS indica il grado di disordine in un sistema, ma c'è una restrizione nell'uso di questa equazione: è applicabile solo ai processi reversibili, cioè quelli in cui il sistema può tornare al suo stato originale senza lasciare traccia di quanto accaduto-.
Nei processi irreversibili, la seconda legge della termodinamica appare così:

Processi reversibili e irreversibili
La tazza di caffè si raffredda sempre ed è un buon esempio di processo irreversibile, poiché avviene sempre in una sola direzione. Se aggiungete la panna al caffè e lo shakerate, otterrete una combinazione molto piacevole, ma per quanto agitate ancora, non avrete il caffè e la panna separatamente, perché mescolare è irreversibile..

Sebbene la maggior parte dei processi quotidiani siano irreversibili, alcuni lo sono quasi reversibile. La reversibilità è un'idealizzazione. Perché ciò avvenga, il sistema deve cambiare molto lentamente, in modo tale che in ogni punto sia sempre in equilibrio. In questo modo è possibile riportarlo allo stato precedente senza lasciare traccia nell'ambiente circostante..
I processi vicini a questo ideale sono più efficienti, poiché forniscono una maggiore quantità di lavoro con un minor consumo di energia..
La forza di attrito è responsabile di gran parte dell'irreversibilità, perché il calore da essa generato non è il tipo di energia che si cerca. Nel libro che scorre sul tavolo, il calore di attrito è energia che non viene recuperata.
Sebbene il libro ritorni alla sua posizione originale, il tavolo sarà stato caldo come una traccia di andare e venire su di esso.
Ora guarda una lampadina a incandescenza: la maggior parte del lavoro svolto dalla corrente attraverso il filamento viene sprecato in calore dall'effetto Joule. Solo una piccola percentuale viene utilizzata per emettere luce. In entrambi i processi (libro e lampadina), l'entropia del sistema è aumentata.
Applicazioni
Un motore ideale è quello costruito utilizzando processi reversibili e privo di attriti che causano spreco di energia, convertendosi quasi tutta l'energia termica nel lavoro utilizzabile.
Sottolineiamo quasi la parola, perché anche il motore ideale, che è quello di Carnot, non è efficiente al 100%. La seconda legge della termodinamica assicura che non sia così.
Motore di Carnot
Il motore Carnot è il motore più efficiente che si possa concepire. Funziona tra due serbatoi di temperatura in due processi isotermici - a temperatura costante - e due processi adiabatici - senza trasferimento di energia termica-.
I grafici chiamati PV-diagramma pressione-volume- chiariscono la situazione a colpo d'occhio:
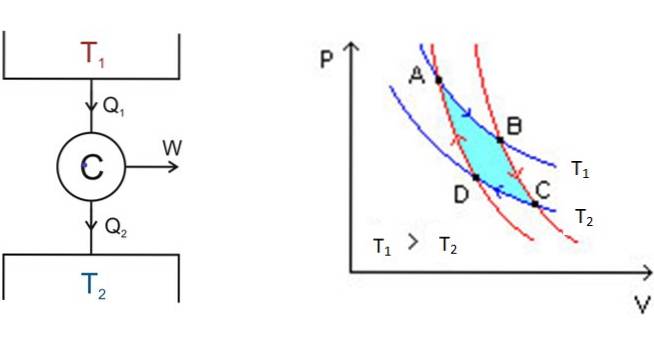
A sinistra, in figura 3 è il diagramma del motore di Carnot C, che prende il calore Q1 della vasca che si trova alla temperatura T1, converte quel calore in lavoro W e produce lo spreco QDue alla vasca più fredda, che è alla temperatura TDue.
Partendo da A, il sistema si espande fino a raggiungere B, assorbendo calore alla temperatura prefissata T1. In B, il sistema inizia un'espansione adiabatica in cui non si guadagna o si perde calore, per raggiungere C.
In C inizia un altro processo isotermico: quello di trasferire calore all'altro deposito termico più freddo che si trova a TDue. Man mano che ciò accade il sistema viene compresso e raggiunge il punto D.Inizia un secondo processo adiabatico per tornare al punto di partenza A. In questo modo si completa un ciclo.
L'efficienza del motore Carnot dipende dalle temperature in kelvin dei due serbatoi termici:
Massima efficienza = (Qiscrizione - QUscita) / Qiscrizione = 1 - (TDue/ T1)
Il teorema di Carnot afferma che questo è il motore termico più efficiente in circolazione, ma non essere troppo veloce per comprarlo. Ricordi cosa abbiamo detto sulla reversibilità del processo? Devono accadere molto, molto lentamente, quindi la potenza di questa macchina è praticamente zero..
Metabolismo umano
Gli esseri umani hanno bisogno di energia per mantenere in funzione tutti i loro sistemi, quindi si comportano come macchine termiche che ricevono energia e la trasformano in energia meccanica per, ad esempio, muoversi.
Efficienza e del corpo umano durante il lavoro può essere definito come il quoziente tra la potenza meccanica che può fornire e l'energia totale immessa, che arriva con il cibo.
Come potenza media Pm è il lavoro W svolto in un intervallo di tempo Δt, può essere espresso come:
Pm = W / Δt
sì ΔU / Δt è la velocità con cui viene aggiunta l'energia, l'efficienza del corpo è come:
Attraverso numerosi test con volontari, sono state ottenute efficienze fino al 17%, erogando circa 100 watt di potenza per diverse ore.
Naturalmente, ciò dipenderà in larga misura dall'attività svolta. Pedalare su una bicicletta è leggermente più efficiente, intorno al 19%, mentre le attività ripetitive che includono pale, picconi e zappe sono solo del 3% circa..
Esempi
La seconda legge della termodinamica è implicita in tutti i processi che avvengono nell'Universo. L'entropia è sempre in aumento, sebbene in alcuni sistemi sembri diminuire. Perché ciò avvenga è dovuto aumentare altrove, quindi nel bilancio totale è positivo.
- Nell'apprendimento c'è entropia. Ci sono persone che imparano le cose bene e velocemente, oltre a poterle ricordare facilmente in seguito. Si dice che siano persone con bassa entropia di apprendimento, ma sicuramente sono meno numerose di quelle con alta entropia: quelle che trovano più difficile ricordare le cose che studiano.
- Un'azienda con lavoratori disorganizzati ha più entropia di una in cui i lavoratori svolgono i compiti in modo ordinato. È chiaro che quest'ultimo sarà più efficiente del primo.
- Le forze di attrito generano una minore efficienza nel funzionamento dei macchinari, poiché aumentano la quantità di energia dissipata che non può essere utilizzata in modo efficiente.
- Il lancio di un dado ha un'entropia maggiore rispetto al lancio di una moneta. Dopo tutto, lanciare una moneta ha solo 2 possibili risultati, mentre lanciare il dado ne ha 6. Più eventi sono probabili, più entropia c'è..
Esercizi risolti
Esercizio 1
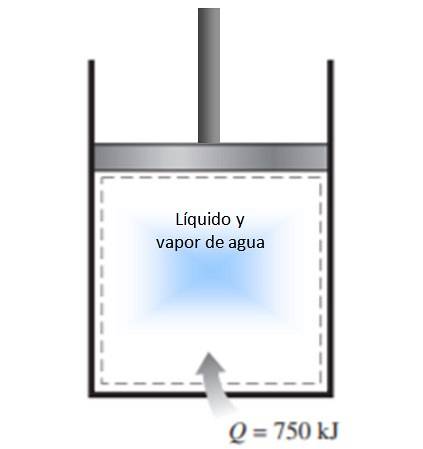
Un cilindro a pistone viene riempito con una miscela di liquido e vapore acqueo a 300 K e 750 kJ di calore viene trasferito all'acqua mediante un processo a pressione costante. Di conseguenza, il liquido all'interno del cilindro vaporizza. Calcola la variazione di entropia nel processo.

Soluzione
Il processo descritto nella dichiarazione viene eseguito a pressione costante in un sistema chiuso, che non subisce scambio di massa.
Trattandosi di una vaporizzazione, durante la quale neanche la temperatura cambia (durante i cambi di fase la temperatura è costante), si può applicare la definizione di variazione di entropia data sopra e la temperatura può uscire dall'integrale:
ΔS = 750.000 J / 300 K = 2500 J / K.
Poiché il calore entra nel sistema, la variazione di entropia è positiva.
Esercizio 2
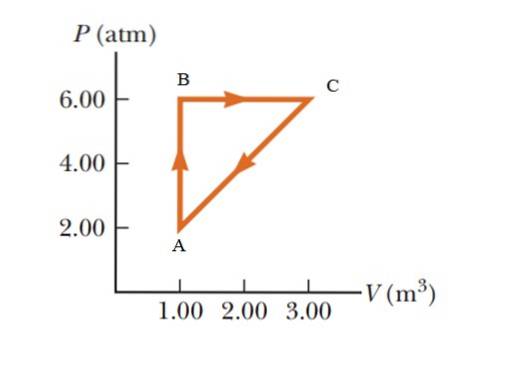
Un gas subisce un aumento di pressione da 2,00 a 6,00 atmosfere (atm), mantenendo un volume costante di 1,00 m3, per poi espandersi a pressione costante fino a raggiungere un volume di 3,00 m3. Infine ritorna al suo stato iniziale. Calcola quanto lavoro viene svolto in 1 ciclo.

Soluzione
È un processo ciclico in cui la variazione di energia interna è nulla, secondo la prima legge della termodinamica, quindi Q = W.In un diagramma PV (pressione - volume), il lavoro svolto durante un processo ciclico è uguale all'area racchiusa da la curva. Per dare i risultati nel Sistema Internazionale, è necessario effettuare una variazione di unità di pressione utilizzando il seguente fattore di conversione:
1 atm = 101,325 kPa = 101,325 Pa.
L'area racchiusa dal grafico corrisponde a quella di un triangolo la cui base (3 - 1 m3) = 2 m3 e la cui altezza è (6-2 atm) = 4 atm = 405.300 Pa
WABCA = ½ (2 m3 x 405300 Pa) = 405300 J = 405,3 kJ.
Esercizio 3
Si dice che una delle macchine più efficienti mai costruite sia una turbina a vapore a carbone sul fiume Ohio, che viene utilizzata per alimentare un generatore elettrico funzionante tra il 1870 e il 430 ° C..
Calcolare: a) Il rendimento teorico massimo, b) La potenza meccanica erogata dalla macchina se assorbe 1,40 x 105 J di energia ogni secondo dal serbatoio caldo. L'efficienza effettiva è nota essere del 42,0%.
Soluzione
a) L'efficienza massima si calcola con l'equazione sopra riportata:
Massima efficienza = (Qiscrizione - Q Uscita) / Qiscrizione = 1 - (TDue/ T1)
Per cambiare i gradi centigradi in kelvin, aggiungi semplicemente 273,15 alla temperatura centigrado:

Moltiplicando per 100% si ottiene la massima efficienza percentuale, che è 67,2%
c) Se l'efficienza reale è del 42%, c'è un'efficienza massima di 0,42.
La potenza meccanica erogata è: P = 0,42 x 1,40 x10 5 J / s = 58800 W..
Riferimenti
- Bauer, W. 2011. Fisica per l'ingegneria e le scienze. Volume 1. Mc Graw Hill.
- Cengel, Y. 2012. Termodinamica. 7ma Edizione. Mcgraw hill.
- Figueroa, D. (2005). Serie: Fisica per la scienza e l'ingegneria. Volume 4. Fluidi e termodinamica. A cura di Douglas Figueroa (USB).
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach.
- López, C. La prima legge della termodinamica. Estratto da: culturacientifica.com.
- Serway, R. 2011. Fondamenti di fisica. 9n / A Cengage Learning.
- Università di Siviglia. Macchine termiche. Recupero da: laplace.us.es



Nessun utente ha ancora commentato questo articolo.