
Struttura, proprietà e usi del seleniuro di idrogeno (H2Se)

Il idrogeno selenio o il seleniuro di idrogeno è un composto inorganico la cui formula chimica è H.DueLo so. È di natura covalente e in normali condizioni di temperatura e pressione è un gas incolore; ma con un forte odore riconoscibile per la sua minore presenza. Chimicamente, è un calcogenuro, quindi il selenio ha una valenza di -2 (SeDue-).
Di tutti i seleniuri, l'HDueÈ il più tossico perché la sua molecola è piccola e il suo atomo di selenio ha meno ostacoli sterici quando reagisce. D'altra parte, il suo odore consente a chi ci lavora di rilevarlo sul posto in caso di perdita fuori dalla cappa del laboratorio..
Il seleniuro di idrogeno può essere sintetizzato dalla combinazione diretta dei suoi due elementi: idrogeno molecolare, H.Due, e selenio metallico. Può anche essere ottenuto sciogliendo composti ricchi di selenio, come il seleniuro di ferro (II), FeSe, in acido cloridrico..
D'altra parte, il seleniuro di idrogeno viene preparato sciogliendo il seleniuro di idrogeno in acqua; cioè il primo è disciolto in acqua, mentre il secondo è costituito da molecole gassose.
Il suo utilizzo principale è quello di essere una fonte di selenio nella sintesi organica e inorganica.
Indice articolo
- 1 Struttura del seleniuro di idrogeno
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Massa molecolare
- 2.3 Punto di ebollizione
- 2.4 Punto di fusione
- 2.5 Pressione di vapore
- 2.6 Densità
- 2.7 pKa
- 2.8 Solubilità in acqua
- 2.9 Solubilità in altri solventi
- 3 Nomenclatura
- 3.1 Seleniuro o idruro?
- 4 Usi
- 4.1 Metabolico
- 4.2 Industriale
- 5 Riferimenti
Struttura del seleniuro di idrogeno
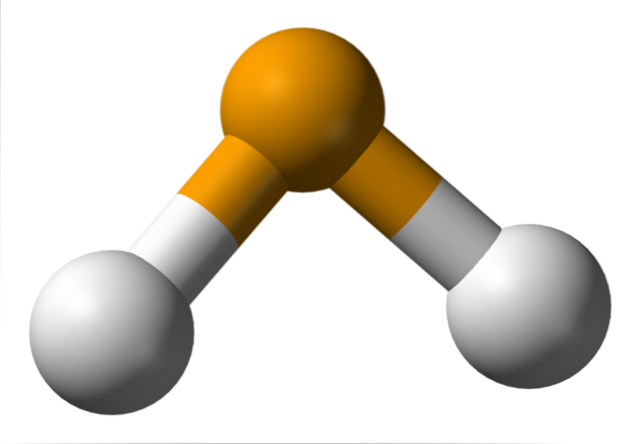
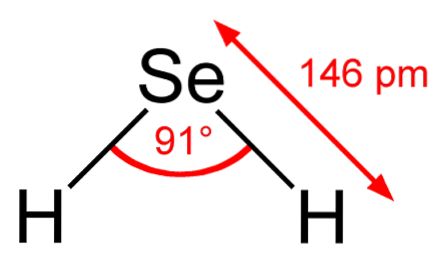
Nell'immagine in alto si osserva che la molecola di H.DueÈ di geometria angolare, sebbene il suo angolo di 91 ° lo faccia sembrare più una L che una V. In questo modello di sfere e barre, gli atomi di idrogeno e selenio sono rispettivamente le sfere bianca e gialla..
Questa molecola, come mostrato, è quella in fase gassosa; cioè per il seleniuro di idrogeno. Una volta sciolto in acqua, rilascia un protone e in soluzione abbiamo la coppia HSe- H3O+; questa coppia di ioni arriva al seleniuro di idrogeno, indicato come HDueSe (ac) per differenziarlo dal seleniuro di idrogeno, H.DueSe (g).
Pertanto, le strutture tra l'HDueSe (ac) e HDueSe (g) sono molto diversi; il primo è circondato da una sfera acquosa e presenta cariche ioniche, e il secondo è costituito da un agglomerato di molecole in fase gassosa.
Molecole di HDuePossono a malapena interagire tra loro da forze dipolo-dipolo molto deboli. Il selenio, sebbene sia meno elettronegativo dello zolfo, concentra una densità elettronica più elevata "portandola via" dagli atomi di idrogeno..
Compresse di idruri di selenio
Se le molecole di H.DueSono sottoposti ad una pressione straordinaria (centinaia di GPa), teoricamente sono costretti a solidificarsi attraverso la formazione di legami Se-H-Se; Questi sono legami di tre centri e due elettroni (3c-2e) a cui partecipa l'idrogeno. Pertanto, le molecole iniziano a formare strutture polimeriche che definiscono un solido..
In queste condizioni, il solido può essere arricchito con più idrogeno, che modifica completamente le strutture risultanti. Inoltre, la composizione diventa di tipo H.nSe, dove n varia da 3 a 6. Pertanto, gli idruri di selenio compressi da queste pressioni e in presenza di idrogeno hanno formule chimiche H3Vedi H6lo so.
Si stima che questi idruri di selenio arricchiti con idrogeno abbiano proprietà superconduttrici.
Proprietà
Aspetto fisico
Gas incolore che a basse temperature odora di ravanello marcio e uova marce se la sua concentrazione aumenta. Il suo odore è peggiore e più intenso di quello dell'idrogeno solforato (che è già abbastanza sgradevole). Tuttavia, questa è una buona cosa, poiché aiuta la sua facile individuazione e riduce i rischi di contatto prolungato o inalazione..
Quando brucia, emette una fiamma bluastra prodotta dalle interazioni elettroniche negli atomi di selenio.
Massa molecolare
80,98 g / mol.
Punto di ebollizione
-41 ° C.
Punto di fusione
-66 ° C.
Pressione del vapore
9,5 atm a 21 ° C.
Densità
3.553 g / L.
pKper
3.89.
Solubilità dell'acqua
0,70 g / 100 mL. Ciò conferma il fatto che l'atomo di selenio di HDueNon è possibile formare legami idrogeno apprezzabili con le molecole d'acqua.
Solubilità in altri solventi
-Solubile in CSDue, il che non sorprende a causa dell'analogia chimica tra selenio e zolfo.
-Solubile in fosgene (a basse temperature, poiché bolle a 8 ° C).
Nomenclatura
Come già spiegato nelle sezioni precedenti, il nome di questo composto varia a seconda che H.DueÈ in fase gassosa o disciolto in acqua. Quando è in acqua, viene indicato come seleniuro di idrogeno, che non è altro che un idracido in termini inorganici. A differenza delle molecole gassose, il suo carattere acido è maggiore.
Tuttavia, sia come gas che disciolto in acqua, l'atomo di selenio mantiene le stesse caratteristiche elettroniche; ad esempio, la sua valenza è -2, a meno che non subisca una reazione di ossidazione. Questa valenza di -2 è il motivo per cui è chiamato seleniuro idrogeno, poiché l'anione seleniuro è SeDue-; che è più reattivo e riducente di SDue-, solfuro.
Se viene utilizzata la nomenclatura sistematica, è necessario specificare il numero di atomi di idrogeno nel composto. Pertanto, l'HDueSi chiama: selenide di ha datoidrogeno.
Seleniuro o idruro?
Alcune fonti lo chiamano idruro. Se lo fosse davvero, il selenio avrebbe una carica positiva di +2 e l'idrogeno avrebbe una carica negativa di -1: SeHDue (Lo soDue+, H-). Il selenio è un atomo più elettronegativo dell'idrogeno, e quindi finisce per "accumulare" la più alta densità di elettroni nella molecola HDuelo so.
Tuttavia, in quanto tale, l'esistenza dell'idruro di selenio non può essere teoricamente esclusa. Infatti, con la presenza degli anioni H- Faciliterà i legami Se-H-Se, responsabili delle solide strutture formate a pressioni enormi secondo studi computazionali.
Applicazioni
Metabolico
Sebbene sembri contraddittorio, nonostante la grande tossicità di H.DueÈ prodotto nel corpo nella via metabolica del selenio. Tuttavia, non appena prodotto, le cellule lo utilizzano come intermedio nella sintesi delle selenoproteine, oppure finisce per essere metilato ed escreto; uno dei sintomi di questo è il sapore dell'aglio in bocca.
Industriale
La HDueViene utilizzato principalmente per aggiungere atomi di selenio a strutture solide, come i materiali semiconduttori; a molecole organiche, come alcheni e nitrili per la sintesi di seleniuri organici; o ad una soluzione per precipitare seleniuri metallici.
Riferimenti
- Wikipedia. (2018). Seleniuro di idrogeno. Estratto da: en.wikipedia.org
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Atomistry. (2012). Seleniuro di idrogeno, H.DueLo so. Estratto da: selenium.atomistry.com
- Tang Y. & col. (2017). Seleniuro di idrogeno (H.DueSe) Gas dopante per impianto di selenio. 21a conferenza internazionale sulla tecnologia di impianto ionico (IIT). Tainan, Taiwan.
- Formulazione chimica. (2018). Seleniuro di idrogeno. Estratto da: formulacionquimica.com
- PubChem. (2019). Seleniuro di idrogeno. Estratto da: pubchem.ncbi.nlm.nih.gov
- Zhang, S. et al. (2015). Diagramma di fase e superconduttività ad alta temperatura degli idruri di selenio compressi. Sci. Rep. 5, 15433; doi: 10.1038 / srep15433.
- Acids.Info. (2019). Acido selenidrico: proprietà e applicazioni di questo idracido. Estratto da: acidos.info/selenhidrico



Nessun utente ha ancora commentato questo articolo.