
Proprietà, usi ed esempi dei sali organici

Il sali organici sono un numero denso di composti ionici con innumerevoli caratteristiche. Sono precedentemente derivati da un composto organico, che ha subito una trasformazione che gli consente di trasportare una carica e, inoltre, la sua identità chimica dipende dallo ione associato.
Nell'immagine sottostante sono mostrate due formule chimiche molto generali per i sali organici. Il primo, R-AX, è interpretato come un composto nella cui struttura di carbonio un atomo, o gruppo A, trasporta una carica positiva + o negativa (-).
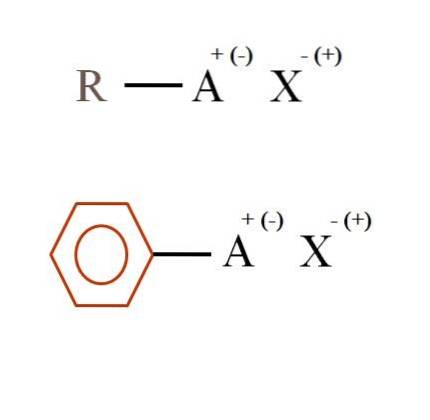
Come si può vedere, c'è un legame covalente tra R e A, RA, ma a sua volta, A ha una carica formale che attrae (o respinge) lo ione X. Il segno della carica dipenderà dalla natura di A e ambiente chimico.
Se A fosse positivo, con quante X potrebbe interagire? Con uno solo, dato il principio di elettroneutralità (+ 1-1 = 0). Tuttavia, qual è l'identità di X? Anion X potrebbe essere CO3Due-, richiedendo due cationi RA+; un alogenuro: F-, Cl-, Br-, eccetera.; o anche un altro composto RA-. Le opzioni sono incalcolabili.
Inoltre, un sale organico può avere carattere aromatico, illustrato dall'anello benzenico marrone. Il sale benzoato di rame (II), (C.6H5COO)DueIl Cu, ad esempio, è costituito da due anelli aromatici con gruppi carbossilici caricati negativamente, che interagiscono con il catione Cu.Due+.
Indice articolo
- 1 Proprietà fisiche e chimiche
- 1.1 Alte masse molecolari
- 1.2 Anfifilici e tensioattivi
- 1.3 Elevati punti di ebollizione o di fusione
- 1.4 Acidità e basicità
- 2 Usi
- 3 Esempi di sali organici
- 3.1 Carbossilati
- 3.2 diachilcuprati di litio
- 3.3 Sali di solfonio
- 3.4 Sali di ossonio
- 3.5 Sali di ammina
- 3.6 Sali di diazonio
- 4 Riferimenti
Proprietà fisiche e chimiche
Dall'immagine si può dire che i sali organici sono costituiti da tre componenti: l'organico, R o Ar (l'anello aromatico), un atomo o gruppo che trasporta la carica ionica A e un controione X.
Così come l'identità e la struttura chimica sono definite da tali componenti, allo stesso modo le loro proprietà dipendono da essi..
Da questo fatto, si possono riassumere alcune proprietà generali che la stragrande maggioranza di questi sali soddisfa..
Elevate masse molecolari
Assumendo anioni X inorganici mono o polivalenti, i sali organici tendono ad avere masse molecolari molto più grandi rispetto ai sali inorganici. Ciò è dovuto principalmente allo scheletro di carbonio, i cui singoli legami C-C e i loro atomi di idrogeno contribuiscono molto alla massa del composto..
Pertanto, R o Ar sono responsabili delle loro masse molecolari elevate..
Anfifilici e tensioattivi
I sali organici sono composti anfifilici, cioè le loro strutture hanno estremità sia idrofile che idrofobiche..
Quali sono questi estremi? R o Ar rappresentano l'estremo idrofobo, perché i loro atomi C e H non hanno una grande affinità per le molecole d'acqua.
PER+(-), l'atomo o gruppo portatore di carica è l'estremità idrofila, poiché contribuisce al momento di dipolo e interagisce con l'acqua, formando dipoli (RA+ OhDue).
Quando le regioni idrofile e idrofobe sono polarizzate, il sale anfifilico diventa un tensioattivo, una sostanza ampiamente utilizzata per la produzione di detergenti e demulsionanti.
Punti di ebollizione o fusione elevati
Come i sali inorganici, anche i sali organici hanno punti di fusione ed ebollizione elevati, dovuti alle forze elettrostatiche che governano la fase liquida o solida..
Tuttavia, poiché esiste una componente organica R o Ar, partecipano altri tipi di forze di Van der Waals (forze di Londra, dipolo-dipolo, legami idrogeno) che competono in un certo modo con l'elettrostatica..
Per questo motivo, le strutture solide o liquide dei sali organici sono, in primo luogo, più complesse e varie. Alcuni di loro potrebbero persino comportarsi come cristalli liquidi.
Acidità e basicità
I sali organici sono generalmente acidi o basi più forti dei sali inorganici. Questo perché A, ad esempio nei sali di ammina, ha una carica positiva a causa del suo legame con un idrogeno aggiuntivo: A+-H. Quindi, a contatto con una base, donare il protone per diventare di nuovo un composto neutro:
RA+H + B => RA + HB
La H appartiene ad A, ma si scrive poiché partecipa alla reazione di neutralizzazione.
D'altra parte, RA+ Può essere una molecola di grandi dimensioni, incapace di formare solidi con un reticolo cristallino sufficientemente stabile con l'anione idrossile o idrossile OH-.
Quando è così, il sale RA+Oh- si comporta come una base forte; anche di base come NaOH o KOH:
RA+Oh- + HCl => RACl + HDueO
Nota nell'equazione chimica che l'anione Cl- sostituisce OH-, formando il sale RA+Cl-.
Applicazioni
L'uso dei sali organici varierà a seconda dell'identità di R, Ar, A e X. Inoltre, la loro applicazione dipende anche dal tipo di solido o liquido che formano. Alcune generalità al riguardo sono:
-Servono come reagenti per la sintesi di altri composti organici. RAX può agire come un "donatore" per la catena R da aggiungere a un altro composto in sostituzione di un buon gruppo uscente.
-Sono tensioattivi, quindi possono essere utilizzati anche come lubrificanti. A questo scopo vengono utilizzati sali metallici di carbossilati.
-Consentono di sintetizzare un'ampia gamma di coloranti.
Esempi di sali organici
Carbossilati
Gli acidi carbossilici reagiscono con un idrossido in una reazione di neutralizzazione, dando origine a sali carbossilati: RCOO- M+; dove M+ può essere qualsiasi catione metallico (Na+, PbDue+, K+, ecc.) o il catione di ammonio NH4+.
Gli acidi grassi sono acidi carbossilici a catena alifatica lunga, possono essere saturi e insaturi. Tra i saturi troviamo l'acido palmitico (CH3(CHDue)14COOH). Questo dà origine al sale palmitato, mentre l'acido stearico (CH3(CHDue)16COOH forma il sale stearato. I saponi sono costituiti da questi sali.
Per il caso dell'acido benzoico, C6H5COOH (dove C6H5- è un anello benzenico), quando reagisce con una base, forma sali benzoati. In tutti i carbossilati il gruppo -COO- rappresenta A (RAX).
Diachilcuprati di litio
Il diachilcuprato di litio è utile nella sintesi organica. La sua formula è [R-Cu-R]-Li+, in cui l'atomo di rame porta una carica negativa. Qui, il rame rappresenta l'atomo A nell'immagine.
Sali di solfonio
Sono formati dalla reazione di un solfuro organico con un alogenuro alchilico:
RDueS + R'X => RDueR'S+X
Per questi sali l'atomo di zolfo porta una carica formale positiva (S.+) avendo tre legami covalenti.
Sali di ossonio
Allo stesso modo, gli eteri (gli analoghi ossigenati dei solfuri) reagiscono con gli idracidi per formare sali di ossonio:
ROR '+ HBr <=> RO+HR '+ fr-
Il protone acido di HBr è legato in modo covalente all'atomo di ossigeno dell'etere (RDueO+-H), caricandolo positivamente.
Sali di ammina
Le ammine possono essere primarie, secondarie, terziarie o quaternarie, come i loro sali. Tutti sono caratterizzati dall'avere un atomo di H legato all'atomo di azoto.
Quindi, RNH3+X- è un sale amminico primario; RDueNHDue+X-, ammina secondaria; R3NH+X-, ammina terziaria; e R4N+X-, ammina quaternaria (sale di ammonio quaternario).
Sali di diazonio
Infine, i sali di diazonio (RNDue+X-) o arildiazonio (ArNDue+X-), rappresentano il punto di partenza di molti composti organici, soprattutto coloranti azoici.
Riferimenti
- Francis A. Carey. Chimica organica. (Sesto ed., Pagine 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Wikipedia. (2018). Sale (chimica). Tratto da: en.wikipedia.org
- Steven A. Hardinger. (2017). Glossario illustrato di chimica organica: sali. Estratto da: chem.ucla.edu
- Chevron Oronite. (2011). Carbossilati. [PDF]. Recupero da: oronite.com


Nessun utente ha ancora commentato questo articolo.