
Formula generale, nomenclatura ed esempi dei sali binari
Il sali binari sono specie ioniche ampiamente conosciute in chimica, identificate come sostanze che fanno parte di elettroliti forti, a causa della loro completa dissociazione nei loro ioni costituenti quando sono in soluzione.
Il termine "binario" si riferisce alla loro formazione, poiché sono composti da due soli elementi: un catione di origine metallica con un semplice anione di origine non metallica (diverso dall'ossigeno), che sono legati da un legame ionico..
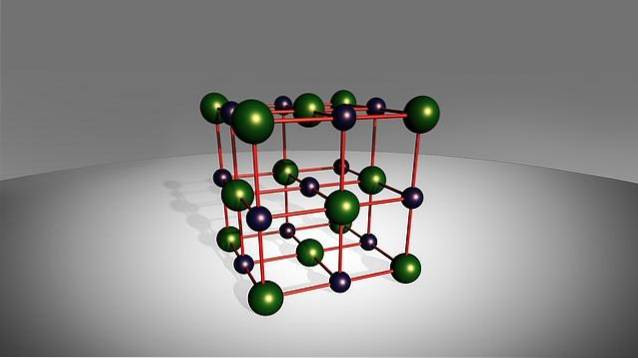
Sebbene il loro nome indichi che sono formati da due soli elementi, ciò non impedisce che in alcuni di questi sali possa esserci più di un atomo del metallo, del non metallico o di entrambe le specie. D'altra parte, alcune di queste specie mostrano un comportamento abbastanza tossico, come il fluoruro di sodio, NaF.
Possono anche mostrare un'elevata reattività a contatto con l'acqua, sebbene tra sali chimicamente molto simili queste proprietà possano variare enormemente..
Indice articolo
- 1 Formula generale dei sali binari
- 2 Nomenclatura dei sali binari
- 2.1 Nomenclatura sistematica
- 2.2 Nomenclatura dei titoli
- 2.3 Nomenclatura tradizionale
- 3 Come si formano i sali binari?
- 4 Esempi di sali binari
- 5 Riferimenti
Formula generale dei sali binari
Come affermato in precedenza, i sali binari sono costituiti da un metallo e da un non metallico nella loro struttura, quindi la loro formula generale è MmXn (dove M è l'elemento metallico e X l'elemento non metallico).
In questo modo, i metalli che fanno parte dei sali binari possono provenire dal blocco "s" della tavola periodica - alcalino (come il sodio) e alcalino terroso (come il calcio) - o dal blocco "p" del tavola periodica (come l'alluminio).
Allo stesso modo, tra gli elementi non metallici che costituiscono questo tipo di sostanze chimiche ci sono quelli del gruppo 17 della tavola periodica, noti come alogeni (come il cloro), nonché altri elementi del blocco "p" come zolfo o azoto, ad eccezione dell'ossigeno.
Nomenclatura dei sali binari
Secondo l'Unione internazionale di chimica pura e applicata (IUPAC), tre sistemi possono essere utilizzati per denominare i sali binari: nomenclatura sistematica, nomenclatura stock e nomenclatura tradizionale.
Nomenclatura sistematica
Quando si utilizza questo metodo, è necessario iniziare con il nome del non metallo, aggiungendo la fine -uro; ad esempio, nel caso di un sale di bromo (Br) sarebbe denominato "bromuro".
Immediatamente dopo aver denominato il non metallo, viene inserita la preposizione "di"; nel caso precedente sarebbe "bromuro di".
Infine, l'elemento metallico prende il nome come viene normalmente chiamato. Pertanto, se si segue lo stesso esempio ed è composto da potassio come il metallo, il composto verrebbe scritto come KBr (la cui struttura è bilanciata correttamente) e si chiama bromuro di potassio..
Nel caso in cui la stechiometria del sale differisca dalla combinazione 1: 1, ogni elemento è denominato utilizzando un prefisso che indica il pedice o il numero di volte in cui ciascuno viene trovato.
Ad esempio, il rapporto di combinazione nel sale CaClDue è 1: 2 (per ogni atomo di calcio ci sono due cloro), quindi è chiamato dicloruro di calcio; si verifica allo stesso modo con gli altri composti.
Nomenclatura azionaria
Quando si utilizza questa procedura, si inizia nominando il composto in un modo molto simile a come è fatto nella nomenclatura sistematica, ma senza anteporre alcun componente della sostanza..
In questo caso viene preso in considerazione solo il numero di ossidazione dell'elemento metallico (il suo valore assoluto in tutti i casi).
Per nominare il sale binario, inserire il numero di valenza in notazione romana tra parentesi, dopo il nome della specie. FeCl può essere fornito come esempioDue che, secondo queste regole, si chiama cloruro di ferro (II).
Nomenclatura tradizionale
Quando si seguono le norme della nomenclatura tradizionale, invece di aggiungere qualche prefisso all'anione o catione del sale o apporre esplicitamente il numero di valenza del metallo, viene invece posto un suffisso a seconda dello stato di ossidazione del metallo.
Per utilizzare questo metodo, il non metallo viene denominato allo stesso modo del metodo stock e, se è presente un sale i cui elementi hanno più di un numero di ossidazione, è necessario denominarlo utilizzando un suffisso che lo indichi..
Nel caso in cui l'elemento metallico utilizzi il suo numero di ossidazione più basso, viene aggiunto il suffisso "orso"; D'altra parte, se usi il suo numero di valenza più alto, viene aggiunto il suffisso "ico"..
Un esempio di ciò potrebbe essere il composto FeCl3, che è chiamato “cloruro ferrico” perché il ferro sta usando la sua massima valenza (3). Nel sale FeClDue, in cui il ferro utilizza la sua valenza più bassa (2), viene utilizzato il nome cloruro ferroso. Succede in modo simile con il resto.
Come si formano i sali binari?
Come accennato in precedenza, queste sostanze di natura prevalentemente neutra si formano attraverso la combinazione per mezzo di un legame ionico di un elemento metallico (come quelli del gruppo 1 della tavola periodica) e di una specie non metallica (come quelli del gruppo 17 di la tavola periodica), ad eccezione degli atomi di ossigeno o idrogeno.
Allo stesso modo, è comune scoprire che nelle reazioni chimiche che coinvolgono i sali binari c'è un rilascio di calore, il che significa che si tratta di una reazione esotermica. Inoltre, ci sono vari rischi a seconda del sale con cui viene trattato.
Esempi di sali binari
Di seguito sono riportati alcuni sali binari insieme ai loro diversi nomi, a seconda della nomenclatura utilizzata:
NaCl
- Cloruro di sodio (nomenclatura tradizionale)
- Cloruro di sodio (nomenclatura stock)
- Monocloruro di sodio (nomenclatura sistematica)
BaClDue
- Cloruro di bario (nomenclatura tradizionale)
- Cloruro di bario (nomenclatura stock)
- Bario dicloruro (nomenclatura sistematica)
CoS
- Solfuro di cobalto (nomenclatura radizionale)
- Solfuro di cobalto (II) (nomenclatura stock)
- Monosolfuro di cobalto (nomenclatura sistematica)
CoDueS3
- Solfuro di cobalto (nomenclatura tradizionale)
- Solfuro di cobalto (III) (nomenclatura stock)
- Dicobalt trisolfuro (nomenclatura sistematica)
Riferimenti
- Wikipedia. (s.f.). Fase binaria. Estratto da en.wikipedia.org
- Chang, R. (2007). Chemistry, Nona edizione (McGraw-Hill).
- Levy, J. M. (2002). Hazmat Chemistry Study Guide, seconda edizione. Recupero da books.google.co.ve
- Burke, R. (2013). Chimica dei materiali pericolosi per i soccorritori di emergenza, terza edizione. Recupero da books.google.co.ve
- Franzosini, P. e Sanesi, M. (2013). Proprietà termodinamiche e di trasporto dei sali organici. Recupero da books.google.co.ve



Nessun utente ha ancora commentato questo articolo.