
Caratteristiche, uso, tecniche, tossicità della safranina
Il safranina È un colorante meriquinoide, chiamato per avere nella sua struttura chimica 2 anelli benzenoidi e 2 anelli quinoidi, questi ultimi sono quelli che forniscono il colore rosso.
È anche chiamato dimetil safranina o rosso basico 2 nella sua forma abbreviata, poiché il suo nome scientifico è 3,7-diamino-2,8-dimetil-5-fenil-fenaziniocloro dimetil safranina e la formula chimica è CventiH19N4 Cl.
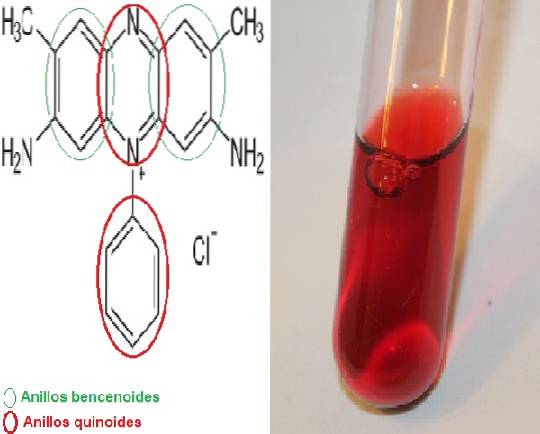
Esiste una variante chiamata trimetil-safranina ma non vi è alcuna differenza significativa tra le due sostanze.
La safranina è un colorante monocromatico e, a seconda delle caratteristiche della formula chimica, è una sostanza caricata positivamente. Pertanto, ha un'affinità per le strutture caricate negativamente. Queste strutture saranno colorate di rosso.
Questa proprietà gli conferisce l'applicabilità in molte tecniche istologiche per colorare varie strutture cellulari, sia in organismi eucarioti che procarioti..
La safranina è utilizzata come colorante di contrasto in tecniche importanti e ben note per l'uso di routine in batteriologia. Queste tecniche sono: la colorazione di Gram-Hucker, la colorazione di Schaeffer Fulton per le spore o la colorazione di capsule batteriche, tra le altre..
Indice articolo
- 1 Caratteristiche
- 2 Usa
- 3 Tecniche nel campo della batteriologia
- 3.1 Colorazione di Castañeda per la colorazione da rickettsie
- 3.2 Colorazione di Koster modificata per Brucella
- 3.3 Colorazione di capsule batteriche
- 3.4 Colorazione delle spore di Schaeffer Fulton
- Colorazione di 3,5 Gram-Hucker
- 4 Tecniche nell'area dell'istologia
- 4.1 Colorazione delle cellule di Kulchitsky (enterocromaffine)
- 4.2 Colorazione per il rilevamento dell'osteoartrosi
- 4.3 Colorazione per l'identificazione delle macroalghe
- 5 Tossicità
- 6 Riferimenti
Caratteristiche
Il colore dello zafferano (una spezia ottenuta dagli stimmi del fiore di Crocus sativus) è stata l'ispirazione per nominare questa colorazione. Dal termine zafferano deriva il nome di safranina. Ciò è dovuto alla grande somiglianza tra il colore dello zafferano e la colorazione che fornisce questo colorante..
La safranina si ottiene sotto forma di cristalli o in polvere, essendo entrambe le presentazioni solubili in acqua. Il colorante safranina è inodore. Macchie strutture rosse. Le strutture che attraggono il colorante safranina sono chiamate safranofili..
Strutturalmente la safranina è complessa, ha due anelli benzenoidi alle estremità e al centro si trovano i due anelli chinoidi dove si trova il catione N.+. Il centro della struttura è il sistema incaricato di fornire il colore. A causa di questa caratteristica, questo colorante è classificato nella categoria II..
Uso
La safranina viene utilizzata per colorare varie strutture. Evidenzia soprattutto le cellule Kulchitsky presenti nel tratto gastrointestinale, chiamate anche cellule enterocromaffine.
È in grado di macchiare microrganismi appartenenti alla famiglia Rickettsiaceae. Allo stesso modo, viene utilizzato in varie tecniche, come il metodo Koster, un modificato utilizzato per la colorazione dei batteri del genere Brucella.
D'altra parte, la safranina viene utilizzata nella tecnica di colorazione delle spore di Schaeffer Fulton e nella colorazione di Gram-Hucker. In entrambe le tecniche, la safranina funziona come colorante di contrasto.
Nella prima, le spore assumono il colore del verde malachite e il resto delle strutture sono rosse dalla safranina. Nel secondo, i batteri Gram negativi perdono il colore del cristallo viola nella fase di decolorazione, quindi la safranina è quella che colora di rosso i batteri Gram negativi.
Inoltre, la safranina viene utilizzata in batteriologia per preparare i terreni agar Brucella con una diluizione 1: 5000 di safranina. Questo mezzo serve a differenziare le specie Brucella suis del resto della specie. Brucella melitensis Y Brucella abortus crescono in questo ambiente ma B. suis è inibito.
In ambito agroindustriale, la safranina è stata utilizzata al 2,25% e diluita 1:10 per colorare campioni di steli della pianta di canna da zucchero.
Questa pianta è comunemente colpita dai batteri Leifsonia xyli subsp. xyli, chi danneggia lo xilema della pianta. Gli steli colorati vengono valutati per determinare la funzione dei vasi xilematici..
Tecniche nel campo della batteriologia
Colorante Castañeda per la colorazione rickettsiae
Uno striscio di sangue o tessuto viene posto in una soluzione tampone (tampone fosfato pH 7,6). Si lascia asciugare spontaneamente e poi si ricopre di blu di metilene per 3 minuti e si contrasta con safranina. Le Rickettsiae sono di colore blu, in contrasto con lo sfondo rosso.
Colorazione Koster modificata per Brucella
Viene fatta una macchia e fiammata nell'accendino per la fissazione. Successivamente, viene ricoperto con una miscela di 2 parti di safranina acquosa saturata con 3 parti di soluzione KOH 1 mol / L, per 1 minuto. Viene lavato con acqua distillata e controcolorato con blu fenilenico all'1%..
Se il campione contiene batteri del genere Brucella questi appariranno arancioni su sfondo blu.
Colorazione della capsula batterica
Si prepara una miscela di sospensione batterica con inchiostro di china e si aggiunge safranina. Al microscopio, si osserverà un alone rossastro attorno a ciascuna capsula batterica con uno sfondo nero..
Colorazione di spore Schaeffer Fulton
Si fa uno striscio con la sospensione batterica. Quindi è fissato per riscaldare. È ricoperto con il 5% di verde malachite, spesso fiammeggiante fino all'emissione dei fumi. Il processo viene ripetuto per 6-10 minuti. Infine si lava con acqua e controcolorata con 0,5% di safranina per 30 secondi. I bacilli si colorano di rosso e le spore di verde.
Colorazione di Gram-Hucker
Si fa uno striscio con sospensione batterica e si fissa al calore. Copri il vetrino con crystal violet per 1 minuto. Quindi lugol viene posto come soluzione mordente per 1 minuto. Successivamente viene sbiancato con alcool acetonico ed infine controcolorato con safranina per 30 secondi..
I batteri Gram positivi si colorano di viola bluastro e i batteri Gram negativi di rosso.
Alcuni laboratori hanno smesso di utilizzare la tecnica Gram-Hucker per adottare la tecnica Gram-Kopeloff modificata. In quest'ultimo, la safranina è sostituita dalla fucsina di base. Questo perché la safranina colora debolmente le specie del genere Legionella, Campylobacter Y Brucella.
Tecniche nell'area dell'istologia
Colorazione delle cellule di Kulchitsky (enterocromaffine)
Le sezioni di tessuto del tratto gastrointestinale sono colorate con cloruro d'argento. Viene quindi decolorato con tiosolfato di sodio e infine controcolorato con safranina.
Le cellule di Kulchitsky si distinguono per la presenza di granuli bruno-nerastri..
Colorazione per l'artrosi
Poiché la safranina ha una carica positiva, si lega molto bene ai gruppi carbossilici e solfato dei glicosaminoglicani. Questi fanno parte dei proteoglicani che compongono la cartilagine articolare. In questo senso, quando si macchia con safranina O, è possibile identificare se c'è o meno una perdita di cartilagine..
La perdita di tessuto cartilagineo può essere misurata utilizzando la scala Mankin o anche chiamata scala dell'osteoartrite..
La tecnica è spiegata di seguito: la sezione istologica viene immersa in un vassoio con la soluzione di ematossilina ferrosa di Weigert, quindi fatta passare attraverso alcool acido e lavata con acqua.
Continuare il processo di colorazione immergendo il vetrino in fast green, viene lavato con acido acetico e ora viene immerso in safranina O. Per terminare il processo, viene disidratato utilizzando alcoli a diverse concentrazioni in ordine crescente. L'ultimo passaggio richiede xilene o xilolo per la chiarificazione del campione.
I vetrini sono condizionati con balsamo del Canada o simili per essere osservati al microscopio..
Con questa tecnica i nuclei si colorano di nero, l'osso verde e la cartilagine dove si trovano i proteoglicani rossi.
Colorante per l'identificazione delle macroalghe
Pérez et al nel 2003 hanno proposto una tecnica semplice ed economica per tingere le macroalghe. I campioni vengono preparati in sezioni istologiche di paraffina. Le sezioni sono fissate con l'1% di glicerina, permettendo loro di asciugarsi completamente. Viene quindi posto in xilolo per rimuovere la paraffina.
La sezione viene reidratata facendola passare attraverso una serie di vassoi contenenti etanolo a diversi gradi di concentrazione (ordine decrescente), per 2 min ciascuno..
Successivamente si colora per 5 minuti con una miscela 3: 1 di safranina 1% con blu di toluidina 1%, entrambe preparate con etanolo al 50%. Alla miscela vengono aggiunte tre gocce di acido picrico, che funge da mordente..
Quindi viene disidratato passando di nuovo attraverso i vassoi alcolici, ma questa volta in modo ascendente. Infine si risciacqua con xilolo e si prepara il campione con balsamo del Canada da osservare..
Tossicità
Fortunatamente, la safranina è una tintura che non rappresenta un pericolo per coloro che la gestiscono. È un colorante innocuo, non è cancerogeno e non è infiammabile..
Il contatto diretto con la pelle o le mucose può provocare un leggero rossore nella zona, senza complicazioni importanti. Per questo, si consiglia di lavare la zona interessata con abbondante acqua.
Riferimenti
- García H. Colorante Safranin O. Tecnico sanitario, 2012; 1 (2): 83-85. Disponibile su: medigraphic.com
- Colorazione Gil M. Gram: fondotinta, materiali, tecnica e usi. Disponibile su: lifeder.com
- Colorazione di Gil M. Spore: razionale, tecniche e usi. Disponibile su: lifeder.com
- Safranina. " Wikipedia, l'enciclopedia libera. 7 marzo 2017, 10:39 UTC. 3 agosto 2019, 20:49 en.wikipedia.org
- Pérez-Cortéz S, Vera B, Sánchez C. Utile tecnica di colorazione nell'interpretazione anatomica di Gracilariopsis tenuifrons Y Gracilaria chilensis (Rhodophyta). Minuti Bot. Venez. 2003; 26 (2): 237-244. Disponibile su: scielo.org.
- Iglesia Aleika, Peralta Esther Lilia, Alvarez Elba, Milián J, Matos Madyu. Relazione tra la funzionalità dei vasi xilematici e la presenza di Leifsonia xyli subsp. xyli. Rev. Veg Protection. 2007; 22 (1): 65-65. Disponibile su: scielo.sld



Nessun utente ha ancora commentato questo articolo.