
Cos'è una soluzione satura? (con esempi)

UN soluzione satura È una soluzione chimica che contiene la massima concentrazione di soluto disciolto in un solvente. È considerato uno stato di equilibrio dinamico in cui le velocità alle quali il solvente dissolve il soluto e la velocità di ricristallizzazione sono uguali (J., 2014).
Il soluto aggiuntivo non si dissolverà in una soluzione satura e apparirà in una fase diversa, o un precipitato se è un solido in liquido o un'effervescenza se è un gas in un liquido (Anne Marie Helmenstine, 2016).
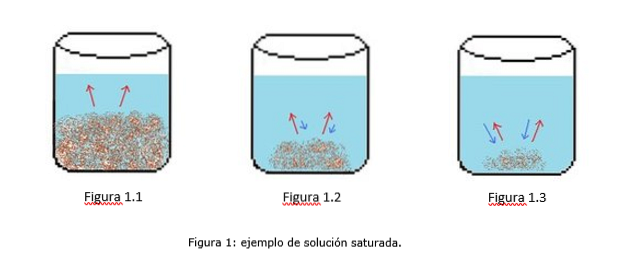
Un esempio di una soluzione satura è illustrato nella Figura 1. Nelle Figure 1.1, 1.2 e 1.3, c'è un volume costante di acqua nel becher. Nella figura 1.1 inizia il processo di saturazione, dove il soluto inizia a dissolversi, rappresentato dalle frecce rosse.
Nella Figura 1.2, gran parte del solido si è dissolto, ma non completamente a causa del processo di ricristallizzazione, rappresentato dalle frecce blu..
Nella Figura 1.3, solo una piccola quantità di soluto rimane indisciolta. In questo caso, la velocità di ricristallizzazione è maggiore della velocità di dissoluzione. (tipes of saturation, 2014)
Il punto di massima concentrazione di un soluto in un solvente è noto come punto di saturazione.
Indice articolo
- 1 Fattori che influenzano la saturazione
- 1.1 Temperatura
- 1.2 Pressione
- 1.3 Composizione chimica
- 1.4 Fattori meccanici
- 2 Curve di saturazione e solubilità
- 3 Esempi di soluzioni sature
- 4 Che cos'è una soluzione sovrasatura?
- 5 Riferimenti
Fattori che influenzano la saturazione
La quantità di soluto che può essere sciolta in un solvente dipenderà da diversi fattori, tra i quali i più importanti sono:
Temperatura
La solubilità aumenta con la temperatura. Ad esempio, più sale può essere sciolto in acqua calda che in acqua fredda..
Tuttavia, possono esserci delle eccezioni, ad esempio, la solubilità dei gas nell'acqua diminuisce con l'aumentare della temperatura. In questo caso, le molecole di soluto ricevono energia cinetica mentre si riscaldano, il che ne facilita la fuga..
Pressione
L'aumento della pressione può forzare la dissoluzione del soluto. Questo è comunemente usato per sciogliere i gas nei liquidi..
Composizione chimica
La natura del soluto e del solvente e la presenza di altri composti chimici nella soluzione influiscono sulla solubilità. Ad esempio, più zucchero può essere sciolto in acqua che sale in acqua. In questo caso si dice che lo zucchero è più solubile.
L'etanolo in acqua è completamente solubile tra loro. In questo caso particolare, il solvente sarà il composto trovato nella quantità maggiore.
Fattori meccanici
A differenza della velocità di dissoluzione, che dipende principalmente dalla temperatura, la velocità di ricristallizzazione dipende dalla concentrazione del soluto sulla superficie del reticolo cristallino, che è favorita quando una soluzione è immobile.
Perciò, mescolando la soluzione evita questo accumulo, massimizzando la dissoluzione (tipes of saturation, 2014).
Curve di saturazione e solubilità
Le curve di solubilità sono un database grafico dove viene confrontata la quantità di soluto che si dissolve in una quantità di solvente, ad una certa temperatura.
Le curve di solubilità sono comunemente tracciate per una quantità di soluto, solido o gas, in 100 grammi di acqua (Brian, 2014).
La Figura 2 illustra le curve di saturazione per vari soluti in acqua..
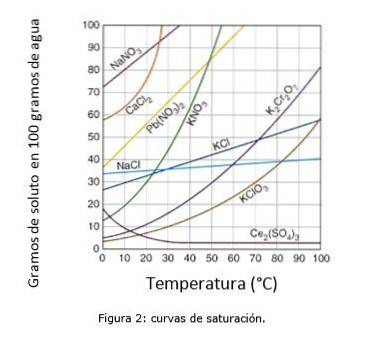
Sull'asse delle coordinate abbiamo la temperatura in gradi centigradi, e sull'asse delle ascisse abbiamo la concentrazione di soluto espressa in grammi di soluto per 100 grammi di acqua.
La curva indica il punto di saturazione a una data temperatura. L'area sotto la curva indica che si dispone di una soluzione insatura e quindi è possibile aggiungere più soluto..
L'area sopra la curva ha una soluzione sovrasatura. (Curve di solubilità, n.d.)
Prendendo come esempio il cloruro di sodio (NaCl), a 25 gradi centigradi circa 35 grammi di NaCl possono essere sciolti in 100 grammi di acqua per ottenere una soluzione satura. (Cambrige University, s.f.)
Esempi di soluzioni sature
Le soluzioni sature possono essere trovate quotidianamente, non è necessario essere in un laboratorio chimico. Il solvente non deve essere necessariamente acqua. Di seguito sono riportati esempi quotidiani di soluzioni sature:
-La soda e le bibite in genere sono soluzioni sature di anidride carbonica in acqua. Ecco perché, quando la pressione viene rilasciata, si formano bolle di anidride carbonica..
-I suoli terrestri sono saturi di azoto.
-Lo zucchero o il sale possono essere aggiunti all'aceto per formare una soluzione satura..
-Aggiungere il cioccolato in polvere al latte fino a quando non si dissolve, forma una soluzione satura.
-Il latte può essere saturo di farina a tal punto che non si può più aggiungere farina al latte.
-Il burro fuso può essere saturo di sale, quando il sale non si scioglie più.
Cos'è una soluzione sovrasatura?
La definizione di una soluzione sovrasatura è quella che contiene più soluto disciolto di quanto potrebbe normalmente essere disciolto nel solvente. Questo di solito viene fatto aumentando la temperatura della soluzione..
Una leggera alterazione della soluzione o l'introduzione di un "seme" o di un minuscolo cristallo di soluto forzerà la cristallizzazione del soluto in eccesso. Se non esiste un punto di nucleazione per la formazione dei cristalli, il soluto in eccesso può rimanere in soluzione.
Un'altra forma di sovrasaturazione può verificarsi quando una soluzione satura viene accuratamente raffreddata. Questo cambiamento di condizioni significa che la concentrazione è effettivamente superiore al punto di saturazione, la soluzione è stata sovrasatura..
Questo può essere utilizzato nel processo di ricristallizzazione per purificare una sostanza chimica: si dissolve fino al punto di saturazione nel solvente caldo, quindi quando il solvente si raffredda e la solubilità diminuisce, il soluto in eccesso precipita.
Le impurità, che sono presenti in una concentrazione molto inferiore, non saturano il solvente e quindi rimangono disciolte nel liquido.
Riferimenti
- Anne Marie Helmenstine, P. (2016, 7 luglio). Definizione ed esempi di soluzione satura. Estratto da about: about.com
- Cambrige University. (s.f.). Curve di solubilità. Estratto da dynamicscience.com: dynamicscience.com.au.
- Esempi di soluzione satura. (s.f.). Estratto da yourdcitionary: examples.yourdictionary.com.
- , S. (2014, 4 giugno). Soluzioni sature e sovrasature. Estratto da socratic.org: socratic.org.
- James, N. (s.f.). Soluzione satura: definizione ed esempi. Estratto da study.com: study.com.
- , B. (2014, 14 ottobre). Soluzioni sature e sovrasature. Estratto da socratic.org: socratic.org.
- Curve di solubilità. (s.f.). Estratto da KentChemistry: kentchemistry.com.
- Tipici di saturazione. (2014, 26 giugno). Estratto da chimica libretex: chem.libretexts.org.



Nessun utente ha ancora commentato questo articolo.