
Formule, proprietà, usi e rischi del nitrato di alluminio
Il nitrato di alluminio È il sale di alluminio dell'acido nitrico. Il nitrato di alluminio nonaidrato, a temperatura ambiente, si presenta come un solido incolore con l'odore di acido nitrico..
Non sono combustibili, ma possono accelerare la combustione di materiali combustibili. Se sono coinvolte grandi quantità di nitrato di alluminio o se il materiale combustibile è finemente suddiviso, può verificarsi un'esplosione..

L'esposizione prolungata al fuoco o al calore può provocare un'esplosione. Quando vengono a contatto con il fuoco, producono ossidi di azoto. I suoi usi includono la raffinazione del petrolio e la tintura e la concia della pelle..
È un sale bianco solubile in acqua che si presenta più comunemente nella sua forma cristallina nonaidrata (nitrato di alluminio nonaidrato)..
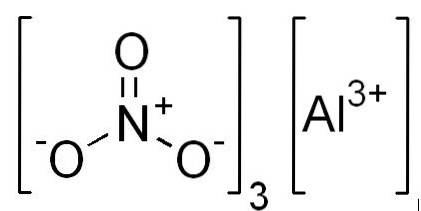
Indice articolo
- 1 Formule
- 2 Struttura
- 2.1 In 2D
- 2.2 In 3D
- 3 Proprietà fisiche e chimiche
- 3.1 Avvisi di reattività
- 3.2 Reazioni con aria e acqua
- 3.3 Infiammabilità
- 3.4 Reattività
- 3.5 Tossicità
- 4 Usi
- 5 Effetti clinici
- 6 Sicurezza e rischi
- 6.1 Classi di pericolo GHS
- 6.2 Codici dei consigli di prudenza
- 7 Riferimenti
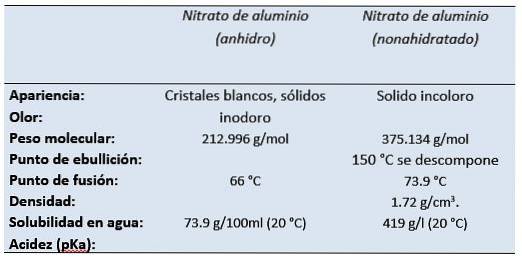
Formule
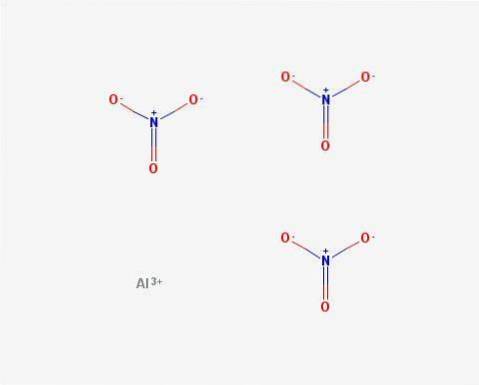
- Nitrato di alluminio: Al (NO3)3
- Nitrato di alluminio nonaidrato: Al (NO3)3 9HDueO
- CAS: 13473-90-0 Nitrato di alluminio (anidro)
- CAS: 14797-65-0 Nitrato di alluminio (nonaidrato)
Struttura
In 2D
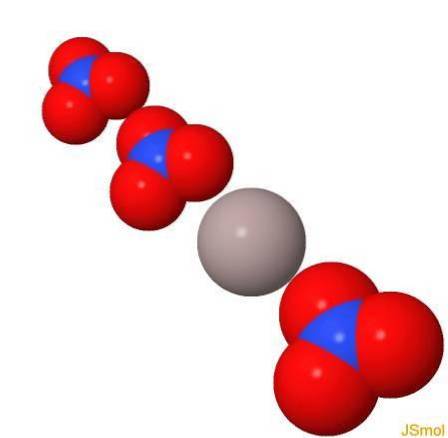
In 3d
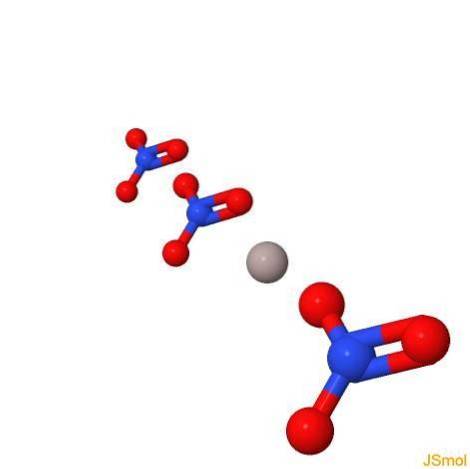
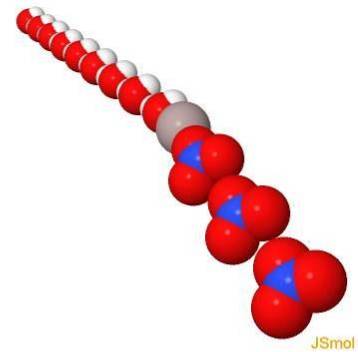
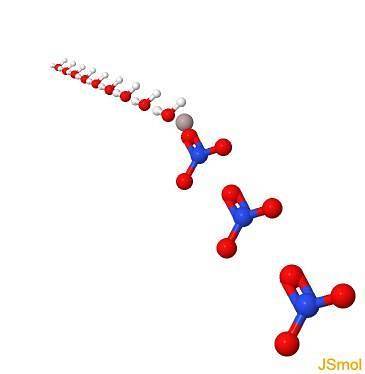
Proprietà fisiche e chimiche
- Il nitrato di alluminio appartiene al gruppo reattivo dei nitrati inorganici e dei composti di nitrito.
- Lo ione nitrato è uno ione poliatomico con la formula molecolare NO3 - ed è la base coniugata dell'acido nitrico.
- Quasi tutti i sali di nitrato inorganici sono solubili in acqua a temperatura e pressione standard..
- I composti nitrati hanno una vasta gamma di usi in base alla loro attività come agenti ossidanti, alla presenza di azoto liberamente disponibile o alla loro elevata solubilità..
Avvisi di reattività
Il nitrato di alluminio è un forte agente ossidante.
Reazioni con aria e acqua
Il nitrato di alluminio è deliquescente (ha la proprietà di assorbire l'umidità dall'aria per formare una soluzione acquosa). È solubile in acqua. Le sue soluzioni acquose sono acide.
Infiammabilità
I nitrati e i nitriti sono composti esplosivi. Alcune di queste sostanze possono decomporsi in modo esplosivo se riscaldate o coinvolte in un incendio. Possono esplodere a causa del calore o della contaminazione. I contenitori possono esplodere se riscaldati.
Pericoli speciali derivanti dai prodotti di combustione: gli ossidi di azoto tossici possono formarsi in un incendio che coinvolge il nitrato di alluminio.
Reattività
I nitrati e i nitriti possono agire come agenti ossidanti estremamente potenti e le miscele con agenti riducenti o materiali ridotti come le sostanze organiche possono essere esplosive. Reagisce con gli acidi per formare biossido di azoto tossico.
In generale, i sali di nitrato e nitrito con cationi redox attivi (metalli di transizione e metalli del gruppo 3a, 4a e 5a della tavola periodica, nonché il catione di ammonio [NH4] +) sono più reattivi con materiali e agenti organici. in condizioni ambientali.
Il nitrato di alluminio è un agente ossidante. Le miscele con esteri alchilici possono esplodere. Miscele con fosforo, stagno (II) cloruro o altri agenti riducenti possono reagire in modo esplosivo.
Tossicità
Gli esseri umani sono soggetti a tossicità da nitrati e nitriti, con i bambini particolarmente vulnerabili alla metaemoglobinemia.
L'ingestione di grandi dosi di nitrato di alluminio provoca irritazione gastrica, nausea, vomito e diarrea. Il contatto con la polvere irrita gli occhi e la pelle.
Applicazioni
Nitrati e nitriti sono ampiamente utilizzati (e in quantità molto elevate) come fertilizzanti in agricoltura per la loro volontà di abbattere e rilasciare azoto per la crescita delle piante e per la loro solubilità, che consente agli ioni nitrati di essere assorbiti dalle radici della pianta.
I composti nitrati sono anche ampiamente usati come materia prima industriale quando è richiesto un agente ossidante o una sorgente ionica di nitrato..
Il nitrato di alluminio viene utilizzato nella produzione di prodotti chimici di laboratorio, cosmetici e per l'igiene personale. Nell'industria viene utilizzato come intermedio nella produzione di altre sostanze.
È utilizzato nella concia delle pelli, negli antitraspiranti, negli inibitori di corrosione, nell'estrazione dell'uranio, nella raffinazione del petrolio e come agente nitrante..
Il nitrato di alluminio nonaidrato e altri nitrati di alluminio idratati hanno molte applicazioni. Questi sali vengono utilizzati per produrre allumina per la preparazione di carte isolanti, negli elementi riscaldanti dei tubi catodici e nei laminati del nucleo dei trasformatori. I sali idrati vengono utilizzati anche per l'estrazione di elementi attinidici.
Effetti clinici
L'alluminio è onnipresente, è il metallo più abbondante nella crosta terrestre. La maggior parte dell'esposizione umana proviene dal cibo. È presente in alcuni prodotti farmaceutici. Nell'industria è ampiamente utilizzato.
L'alluminio inibisce il rimodellamento osseo, provocando l'osteomalacia. Si ritiene che inibisca l'eritropoiesi, causando anemia.
L'avvelenamento acuto è raro. Le forme solubili di alluminio hanno un maggiore potenziale di tossicità rispetto alle forme insolubili, a causa del loro maggiore assorbimento..
I pazienti con insufficienza renale sono inclini alla tossicità dell'alluminio, dall'alluminio nel dializzato o da altre fonti esogene, in particolare i leganti del fosfato e gli antiacidi contenenti alluminio..
L'esposizione cronica alla polvere di alluminio può causare dispnea, tosse, fibrosi polmonare, pneumotorace, pneumoconiosi, encefalopatia, debolezza, incoordinazione e convulsioni epilettiformi..
I sali di alluminio possono causare irritazione agli occhi e alle mucose, congiuntivite, dermatosi ed eczema..
Sebbene l'alluminio ei suoi composti abbiano mostrato poche prove di cancerogenicità nell'uomo, l'esposizione ad altre sostanze coinvolte nella produzione di alluminio è stata associata a cancerogenicità..
Sicurezza e rischi
Indicazioni di pericolo del Sistema mondiale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS).
Il sistema globale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS) è un sistema concordato a livello internazionale, creato dalle Nazioni Unite e progettato per sostituire i vari standard di classificazione ed etichettatura utilizzati nei diversi paesi utilizzando criteri coerenti a livello globale..
Le classi di pericolo (e il capitolo corrispondente del GHS), gli standard di classificazione ed etichettatura e le raccomandazioni per il nitrato di alluminio e per il nitrato di alluminio nonaidrato sono le seguenti (Agenzia europea per le sostanze chimiche, 2017; Nazioni Unite, 2015; PubChem, 2017):
Classi di pericolo GHS
H272: Può aggravare un incendio; Ossidante [Avvertenza Liquidi ossidanti; Solidi ossidanti - Categoria 3] (PubChem, 2017).
H301: Tossico se ingerito [Pericolo di tossicità acuta, orale - Categoria 3] (PubChem, 2017).
H315: Provoca irritazione cutanea [Attenzione Corrosione / irritazione cutanea - Categoria 2] (PubChem, 2017).
H318: Provoca gravi lesioni oculari [Pericolo Lesioni oculari gravi / irritazione oculare - Categoria 1] (PubChem, 2017).
H319: Provoca grave irritazione oculare [Attenzione Lesioni oculari gravi / irritazione oculare - Categoria 2A] (PubChem, 2017).
Codici dei consigli di prudenza
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405 e P501 (PubChem, 2017).





Riferimenti
- ChemIDplus (2017) Struttura 3D di 13473-90-0 - Nitrato di alluminio [immagine] Estratto da: chem.nlm.nih.gov.
- ChemIDplus (2017) Struttura 3D di 7784-27-2 - Nitrato di alluminio nonaidrato [immagine] Estratto da: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery at Dusk [immagine] Estratto da: flickr.com.
- Edgar181 (2008) Nitrato di alluminio [immagine]. Estratto da: wikipedia.org.
- Agenzia europea per le sostanze chimiche (ECHA). (2016). Nitrato di alluminio. Breve profilo. Estratto l'8 febbraio 2017 da echa.europa.eu.
- Banca dati sulle sostanze pericolose (HSDB). TOXNET. (2017). Nitrato di alluminio. Bethesda, MD, UE: Biblioteca nazionale di medicina. Estratto da: chem.nlm.nih.gov.
- JSmol (2017) Nitrate [immagine] Estratto da: chemapps.stolaf.edu.
- Wikipedia. (2017). Nitrato di alluminio. Estratto l'8 febbraio 2017 da: wikipedia.org.
- Wikipedia. (2017). Nitrato di alluminio nonaidrato. Estratto l'8 febbraio 2017 da: wikipedia.org.



Nessun utente ha ancora commentato questo articolo.