
Caratteristiche, equazioni ed esempi di reazioni endotermiche

UN reazione endotermica È uno che per avere luogo deve assorbire energia, sotto forma di calore o radiazione, dall'ambiente circostante. Generalmente, ma non sempre, possono essere riconosciuti da un abbassamento della temperatura nel loro ambiente; oppure, al contrario, necessitano di una fonte di calore, come quella ottenuta da una fiamma ardente.
L'assorbimento di energia o calore è ciò che accomuna tutte le reazioni endotermiche; la loro natura, così come le trasformazioni coinvolte, sono molto diverse. Quanto calore dovrebbero assorbire? La risposta dipende dalla sua termodinamica: la temperatura alla quale la reazione avviene spontaneamente.

Ad esempio, una delle reazioni endotermiche più emblematiche è il cambio di stato da ghiaccio ad acqua liquida. Il ghiaccio deve assorbire calore fino a quando la sua temperatura non raggiunge circa 0ºC; a quella temperatura il suo scioglimento diventa spontaneo, e il ghiaccio si assorbirà fino a quando non si sarà completamente sciolto.
Negli spazi caldi, come sulle rive di una spiaggia, le temperature sono più alte e quindi il ghiaccio assorbe il calore più velocemente; cioè si scioglie più velocemente. Lo scioglimento dei ghiacciai è un esempio di una reazione endotermica indesiderabile.
Perché succede in questo modo? Perché il ghiaccio non può apparire come un solido caldo? La risposta sta nell'energia cinetica media delle molecole d'acqua in entrambi gli stati e nel modo in cui interagiscono tra loro attraverso i loro legami idrogeno..
Nell'acqua liquida, le sue molecole hanno maggiore libertà di movimento rispetto al ghiaccio, dove vibrano stazionarie nei suoi cristalli. Per muoversi, le molecole devono assorbire energia in modo tale che le loro vibrazioni rompano i forti legami idrogeno direzionali nel ghiaccio..
Per questo motivo il ghiaccio assorbe il calore per sciogliersi. Perché esista il "ghiaccio caldo", i legami idrogeno dovrebbero essere anormalmente forti per fondersi a una temperatura ben al di sopra di 0 ° C..
Indice articolo
- 1 Caratteristiche di una reazione endotermica
- 1,1 ΔH> 0
- 1.2 Raffrescano l'ambiente circostante
- 2 Equazioni
- 3 Esempi di reazioni endotermiche comuni
- 3.1 Evaporazione del ghiaccio secco
- 3.2 Cuocere il pane o cuocere il cibo
- 3.3 Prendere il sole
- 3.4 Reazione dell'azoto atmosferico e formazione di ozono
- 3.5 Elettrolisi dell'acqua
- 3.6 Fotosintesi
- 3.7 Soluzioni di alcuni sali
- 3.8 Decomposizioni termiche
- 3.9 Cloruro di ammonio in acqua
- 3.10 Triosolfato di sodio
- 3.11 Motori di automobili
- 3.12 Liquidi bollenti
- 3.13 Cucinare un uovo
- 3.14 Cucinare il cibo
- 3.15 Riscaldare il cibo nel microonde
- 3.16 Stampaggio del vetro
- 3.17 Consumo di una candela
- 3.18 Pulizia con acqua calda
- 3.19 Sterilizzazione a caldo di alimenti e altri oggetti
- 3.20 Combattere le infezioni con febbre
- 3.21 Evaporazione dell'acqua
- 4 Riferimenti
Caratteristiche di una reazione endotermica
Il cambiamento di stato non è propriamente una reazione chimica; tuttavia, accade la stessa cosa: il prodotto (acqua liquida) ha un'energia maggiore del reagente (ghiaccio). Questa è la caratteristica principale di una reazione o processo endotermico: i prodotti sono più energetici dei reagenti.
Anche se questo è vero, non significa che i prodotti debbano essere necessariamente instabili. In tal caso, la reazione endotermica non è più spontanea in tutte le condizioni di temperatura o pressione..
Considera la seguente equazione chimica:
A + Q => B
Dove Q rappresenta il calore, solitamente espresso in unità di joule (J) o calorie (cal). Poiché A assorbe il calore Q per trasformarsi in B, allora si dice che sia una reazione endotermica. Quindi, B ha più energia di A e deve assorbire abbastanza energia per ottenere la sua trasformazione.
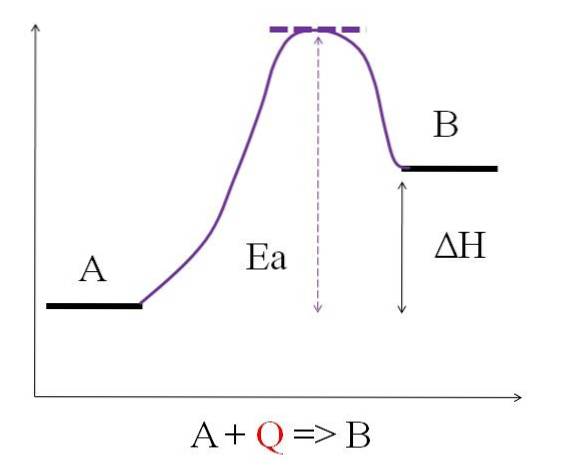
Come si può vedere nel diagramma sopra, A ha meno energia di B. La quantità di calore Q assorbita da A è tale da superare l'energia di attivazione (l'energia necessaria per raggiungere il picco viola con il tetto punteggiato). La differenza di energia tra A e B è nota come entalpia della reazione, ΔH.
ΔH> 0
Tutte le reazioni endotermiche hanno in comune il diagramma sopra, poiché i prodotti sono più energetici dei reagenti. Pertanto, la differenza di energia tra loro, ΔH, è sempre positiva (H.Prodotto-HReagente > 0). Poiché questo è vero, deve esserci un assorbimento di calore o energia dall'ambiente circostante per fornire questo fabbisogno energetico..
E come vengono interpretate tali espressioni? In una reazione chimica, i legami vengono sempre rotti per crearne di nuovi. Per romperli è necessario l'assorbimento di energia; cioè, è un passaggio endotermico. Nel frattempo, la formazione dei legami implica stabilità, quindi è un passaggio esotermico..
Quando i legami formati non forniscono stabilità paragonabile alla quantità di energia richiesta per rompere i vecchi legami, si tratta di una reazione endotermica. Questo è il motivo per cui è necessaria energia aggiuntiva per promuovere la rottura dei legami più stabili nei reagenti..
D'altra parte, nelle reazioni esotermiche avviene il contrario: il calore viene rilasciato e ΔH lo è < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Raffreddano l'ambiente circostante
Sebbene non si applichi a tutte le reazioni endotermiche, molte di esse provocano una diminuzione della temperatura dell'ambiente circostante. Questo perché il calore assorbito proviene da qualche parte. Di conseguenza, se la conversione di A e B fosse effettuata all'interno di un contenitore, sarebbe raffreddato.
Più endotermica è la reazione, più freddo diventerà il contenitore e l'ambiente circostante. Alcune reazioni, infatti, sono addirittura in grado di formare un sottile strato di ghiaccio, come se uscisse da un frigorifero..
Tuttavia, ci sono reazioni di questo tipo che non raffreddano l'ambiente circostante. Perché? Perché il calore circostante è insufficiente; cioè, non fornisce il Q (J, cal) necessario scritto nelle equazioni chimiche. Pertanto, questo è quando entra il fuoco o la radiazione ultravioletta..
Potrebbe sorgere un po 'di confusione tra i due scenari. Da un lato, il calore dell'ambiente è sufficiente perché la reazione proceda spontaneamente e si osserva il raffreddamento; e dall'altra, è necessario più calore e viene utilizzato un metodo di riscaldamento efficiente. In entrambi i casi accade la stessa cosa: l'energia viene assorbita.
Equazioni
Quali sono le equazioni rilevanti in una reazione endotermica? Come già spiegato, il ΔH deve essere positivo. Per calcolarlo, viene prima considerata la seguente equazione chimica:
aA + bB => cC + dD
Dove A e B sono i reagenti e C e D sono i prodotti. Le lettere minuscole (a, b, c e d) sono i coefficienti stechiometrici. Per calcolare il ΔH di questa reazione generica, viene applicata la seguente espressione matematica:
ΔHProdotti- ΔHReagenti = ΔHrxn
Puoi procedere direttamente o eseguire i calcoli separatamente. Per ΔHProdotti deve essere calcolata la seguente somma:
c ΔHFC + d ΔHFD
Dove ΔHF è l'entalpia di formazione di ciascuna sostanza coinvolta nella reazione. Per convenzione, le sostanze nelle loro forme più stabili hanno ΔHF= 0. Ad esempio, le molecole di ODue e H.Due, o un metallo solido, hanno ΔHF= 0.
Lo stesso calcolo viene eseguito ora per i reagenti, ΔHReagenti:
a ΔHFA + b ΔHFB
Ma poiché l'equazione dice che ΔHReagenti deve essere sottratto da ΔHProdotti, quindi la somma di cui sopra deve essere moltiplicata per -1. Quindi hai:
c ΔHFC + d ΔHFD - (a ΔHFA + b ΔHFB)
Se il risultato di questo calcolo è un numero positivo, allora è una reazione endotermica. E se risulta negativo, è una reazione esotermica.
Esempi di reazioni endotermiche comuni
Evaporazione del ghiaccio secco

Chiunque abbia mai visto quei fumi bianchi emanarsi da un carretto dei gelati è stato testimone di uno degli esempi più comuni di "reazione" endotermica.
Oltre ad alcuni gelati, anche questi vapori emessi da solidi bianchi, chiamati ghiaccio secco, hanno fatto parte degli scenari per creare l'effetto della nebbia. Questo ghiaccio secco non è altro che anidride carbonica solida, che assorbendo la temperatura e prima che la pressione esterna inizi a sublimare.
Un esperimento per un pubblico di bambini sarebbe quello di riempire e sigillare un sacchetto con ghiaccio secco. Dopo un po ', alla fine si gonfierà a causa della CODue gassoso, che genera lavoro o preme le pareti interne del sacco contro la pressione atmosferica.
Cuocere il pane o cuocere il cibo

La cottura del pane è un esempio di reazione chimica, poiché ora ci sono cambiamenti chimici dovuti al calore. Chiunque abbia annusato l'aroma del pane appena sfornato sa che si sta verificando una reazione endotermica.
L'impasto e tutti i suoi ingredienti hanno bisogno del calore del forno per svolgere tutte le trasformazioni, indispensabili per diventare pane ed esibire le sue caratteristiche tipiche..
Oltre al pane, la cucina è ricca di esempi di reazioni endotermiche. Chi cucina se ne occupa quotidianamente. Cucinare la pasta, ammorbidire i chicchi, riscaldare i chicchi di mais, cuocere le uova, condire le carni, cuocere una torta, preparare il tè, riscaldare i panini; ciascuna di queste attività sono reazioni endotermiche.
Prendere il sole

Per quanto semplici e comuni possano sembrare, i bagni di sole presi da alcuni rettili, come tartarughe e coccodrilli, rientrano nella categoria delle reazioni endotermiche. Le tartarughe assorbono il calore dal sole per regolare la loro temperatura corporea.
Senza il sole, trattengono il calore dell'acqua per scaldarsi; che finisce nel raffreddamento dell'acqua nei vostri stagni o acquari.
Reazione dell'azoto atmosferico e formazione di ozono

L'aria è composta principalmente da azoto e ossigeno. Durante le tempeste elettriche, viene rilasciata una tale energia che può rompere i forti legami che tengono insieme gli atomi di azoto nella molecola N.Due:
NDue + ODue + Q => 2NO
D'altra parte, l'ossigeno può assorbire la radiazione ultravioletta per trasformarsi in ozono; allotropo dell'ossigeno che è molto benefico nella stratosfera, ma dannoso per la vita a livello del suolo. La reazione è:
3ODue + v => 2O3
Dove v significa radiazione ultravioletta. Il meccanismo alla base di questa semplice equazione è molto complesso.
Elettrolisi dell'acqua
L'elettrolisi utilizza l'energia elettrica per separare una molecola nei suoi elementi o molecole formanti. Ad esempio, nell'elettrolisi dell'acqua si generano due gas: idrogeno e ossigeno, ciascuno in elettrodi diversi:
2HDueO => 2HDue + ODue
Inoltre, il cloruro di sodio può subire questa stessa reazione:
2NaCl => 2Na + ClDue
In un elettrodo vedrai la formazione di sodio metallico e nell'altro bolle verdastre di cloro.
Fotosintesi

Le piante e gli alberi devono assorbire la luce solare come fonte di energia per sintetizzare i loro biomateriali. Per questo utilizza la CO come materia prima.Due e l'acqua, che attraverso una lunga serie di passaggi, vengono convertite in glucosio e altri zuccheri. Inoltre, si forma l'ossigeno, che viene rilasciato dalle foglie.
Soluzioni di alcuni sali
Se il cloruro di sodio viene sciolto in acqua, non ci saranno cambiamenti evidenti nella temperatura esterna del vetro o del contenitore..
Alcuni sali, come il cloruro di calcio, CaClDue, aumentare la temperatura dell'acqua come prodotto della grande idratazione degli ioni CaDue+. E altri sali, come nitrato di ammonio o cloruro, NH4NON3 e NH4Cl, abbassa la temperatura dell'acqua e raffredda l'ambiente circostante.
Nelle aule, gli esperimenti domestici vengono solitamente eseguiti sciogliendo alcuni di questi sali per dimostrare cos'è una reazione endotermica..
Il calo di temperatura è dovuto all'idratazione degli ioni NH4+ non è favorito contro la dissoluzione delle disposizioni cristalline dei suoi sali. Di conseguenza, i sali assorbono calore dall'acqua per consentire la solvatazione degli ioni..
Un'altra reazione chimica che di solito è molto comune per dimostrarlo è la seguente:
Ba (OH)Due8HDueO + 2NH4NON3 => Ba (NO3)Due + 2NH3 +10HDueO
Nota la quantità di acqua formata. Mescolando entrambi i solidi, una soluzione acquosa di Ba (NO3)Due, odorando di ammoniaca e con un calo di temperatura tale da congelare letteralmente la superficie esterna del contenitore.
Decomposizioni termiche
Una delle decomposizioni termiche più comuni è quella del bicarbonato di sodio, NaHCO3, per produrre CODue e acqua quando riscaldato. Molti solidi, inclusi i carbonati, spesso si decompongono per rilasciare CODue e il corrispondente ossido. Ad esempio, la decomposizione del carbonato di calcio è la seguente:
Ladro3 + Q => CaO + CODue
Lo stesso accade con i carbonati di magnesio, stronzio e bario.
È importante notare che la decomposizione termica è diversa dalla combustione. Nella prima non c'è presenza di accensione o si sprigiona calore, mentre nella seconda c'è; cioè, la combustione è una reazione esotermica, anche quando necessita di una fonte di calore iniziale che avvenga o avvenga spontaneamente.
Cloruro di ammonio in acqua
Quando una piccola quantità di cloruro di ammonio (NH4Cl) viene sciolta in acqua in una provetta, la provetta diventa più fredda di prima. Durante questa reazione chimica, il calore viene assorbito dall'ambiente.
Triosolfato di sodio
Quando i cristalli di tiosolfato di sodio (NaDueSDueO3.5HDueO), comunemente chiamato singhiozzo, si dissolve in acqua, si verifica un effetto di raffreddamento.
Motori di automobili
La combustione di benzina o diesel nei motori di automobili, camion, trattori o autobus produce energia meccanica, che viene utilizzata nella circolazione di questi veicoli.
Liquidi bollenti
Mettendo a riscaldare un liquido, guadagna energia e va allo stato gassoso.
Cuoci un uovo
Quando viene applicato il calore, le proteine dell'uovo vengono denaturate, formando la struttura solida che di solito viene ingerita..
Cucinare il cibo
In generale, sempre quando si cucina con il calore per modificare le proprietà del cibo, si verificano reazioni endotermiche.
Queste reazioni sono ciò che induce il cibo a diventare più morbido, a generare masse malleabili, a rilasciare i componenti che contengono, tra le altre cose..
Riscaldare il cibo nel microonde
Con la radiazione a microonde, le molecole d'acqua nel cibo assorbono energia, iniziano a vibrare e aumentano la temperatura del cibo.
Stampaggio del vetro
L'assorbimento del calore da parte del vetro rende le sue articolazioni flessibili, facilitando il cambiamento della sua forma.
Consumo di una candela
La cera di candela si scioglie assorbendo il calore dalla fiamma, modificandone la forma.
Pulizia con acqua calda
Quando si utilizza acqua calda per pulire oggetti che sono stati macchiati di grasso, come pentole o vestiti, il grasso diventa più liquido ed è più facile da rimuovere.
Sterilizzazione a caldo di cibo e altri oggetti
Quando si riscaldano oggetti o alimenti, i microrganismi in essi contenuti aumentano anche la loro temperatura.
Quando viene fornito molto calore, si verificano reazioni all'interno delle cellule microbiche. Molte di queste reazioni, come la rottura dei legami o la denaturazione delle proteine, finiscono per uccidere i microrganismi.
Combatti le infezioni con la febbre
Quando si verifica la febbre, è perché il corpo produce il calore necessario per uccidere batteri e virus che causano infezioni e generano malattie..
Se il calore generato è molto e la febbre è alta, anche le cellule del corpo ne risentono e c'è il rischio di morte.
Evaporazione dell'acqua
Quando l'acqua evapora e si trasforma in vapore, è dovuto al calore che riceve dall'ambiente. Man mano che l'energia termica viene ricevuta da ciascuna molecola d'acqua, la sua energia di vibrazione aumenta fino al punto in cui può muoversi liberamente, creando vapore..
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Wikipedia. (2018). Processo endotermico. Estratto da: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27 dicembre 2018). Esempi di reazioni endotermiche. Estratto da: thoughtco.com
- Khan Academy. (2019). Endotermico vs. reazioni esotermiche. Estratto da: khanacademy.org
- Serm Murmson. (2019). Cosa succede a livello molecolare durante una reazione endotermica? Hearst Seattle Media. Estratto da: education.seattlepi.com
- QuimiTube. (2013). Calcolo dell'entalpia di reazione dalle entalpie di formazione. Estratto da: quimitube.com
- Quimicas.net (2018). Esempi di reazione endotermica. Recuperato da:
chemistry.net.



Nessun utente ha ancora commentato questo articolo.