
Cosa sono le soluzioni acquose? (Con esempi)
Il soluzione acquosa sono quelle soluzioni che usano l'acqua per decomporre una sostanza. Ad esempio, fango o acqua zuccherata. Quando una specie chimica si è dissolta in acqua, ciò viene indicato scrivendo (aq) dopo il nome chimico.
Le sostanze idrofile (che amano l'acqua) e molti composti ionici si dissolvono o si dissociano in acqua. Ad esempio, quando il sale da cucina o il cloruro di sodio si dissolvono in acqua, si dissociano nei suoi ioni per formare Na + (aq) e Cl- (aq).

Le sostanze idrofobiche (che temono l'acqua) generalmente non si dissolvono in acqua né formano soluzioni acquose. Ad esempio, la miscelazione di olio e acqua non porta alla dissoluzione o alla dissociazione.
Molti composti organici sono idrofobici. I non elettroliti possono dissolversi in acqua, ma non si dissociano in ioni e mantengono la loro integrità come molecole. Esempi di non elettroliti includono zucchero, glicerolo, urea e metilsulfonilmetano (MSM).
Proprietà delle soluzioni acquose
Le soluzioni acquose spesso conducono elettricità. Le soluzioni contenenti elettroliti forti tendono ad essere buoni conduttori elettrici (es. Acqua di mare), mentre le soluzioni contenenti elettroliti deboli tendono ad essere cattivi conduttori (es. Acqua di rubinetto).
Il motivo è che gli elettroliti forti si dissociano completamente in ioni nell'acqua, mentre gli elettroliti deboli si dissociano in modo incompleto..
Quando le reazioni chimiche tra le specie avvengono in una soluzione acquosa, le reazioni sono solitamente reazioni di doppio spostamento (chiamate anche metatesi o doppia sostituzione)..
In questo tipo di reazione, il catione in un reagente prende il posto del catione nell'altro reagente, formando tipicamente un legame ionico. Un altro modo di pensare a questo proposito è che gli ioni reattivi "cambiano partner".
Le reazioni in soluzione acquosa possono produrre prodotti che sono solubili in acqua o possono produrre un precipitato..
Un precipitato è un composto con una bassa solubilità che spesso cade dalla soluzione come solido..
I termini acido, base e pH si applicano solo alle soluzioni acquose. Ad esempio, puoi misurare il pH del succo di limone o dell'aceto (due soluzioni acquose) e sono acidi deboli, ma non puoi ottenere alcuna informazione significativa dal test dell'olio vegetale con carta pH..
Perché alcuni solidi si dissolvono in acqua?
Lo zucchero che usiamo per addolcire il caffè o il tè è un solido molecolare, in cui le singole molecole sono tenute insieme da forze intermolecolari relativamente deboli..
Quando lo zucchero si dissolve in acqua, i deboli legami tra le singole molecole di saccarosio vengono rotti e queste molecole C12H22O11 vengono rilasciate in soluzione..
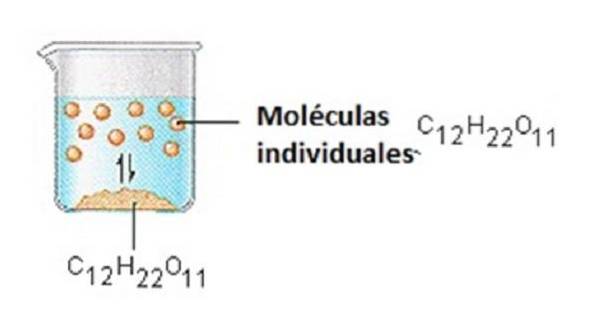
Ci vuole energia per rompere i legami tra le molecole C12H22O11 nel saccarosio. Ci vuole anche energia per rompere i legami idrogeno in acqua che devono essere rotti per inserire una di queste molecole di saccarosio in soluzione..
Lo zucchero si dissolve in acqua perché l'energia viene rilasciata quando le molecole di saccarosio leggermente polari formano legami intermolecolari con le molecole di acqua polare..
I deboli legami che si formano tra il soluto e il solvente compensano l'energia richiesta per alterare la struttura sia del soluto puro che del solvente..
Nel caso di zucchero e acqua, questo processo funziona così bene che fino a 1800 grammi di saccarosio possono essere sciolti in un litro d'acqua..
I solidi ionici (o sali) contengono ioni positivi e negativi, che vengono tenuti insieme grazie alla grande forza di attrazione tra particelle con cariche opposte.
Quando uno di questi solidi si dissolve in acqua, gli ioni che compongono il solido vengono rilasciati in soluzione, dove si associano alle molecole di solvente polare..
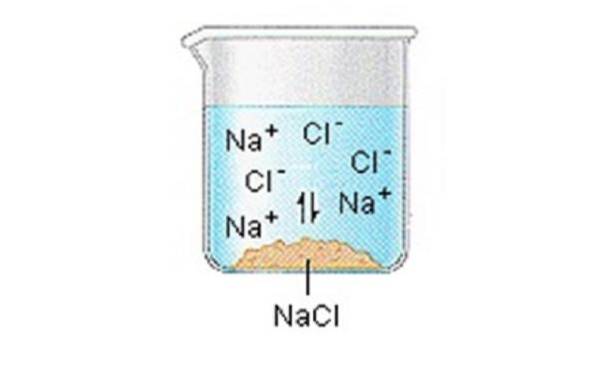
NaCl (s) "Na + (aq) + Cl- (aq)
In genere possiamo presumere che i sali si dissocino nei loro ioni quando disciolti in acqua..
I composti ionici si dissolvono in acqua se l'energia rilasciata quando gli ioni interagiscono con le molecole d'acqua supera l'energia necessaria per rompere i legami ionici nel solido e l'energia necessaria per separare le molecole d'acqua in modo che gli ioni possano essere inseriti nella soluzione.
Regole di solubilità
A seconda della solubilità di un soluto, ci sono tre possibili risultati:
1) Se la soluzione ha meno soluto della quantità massima che è in grado di sciogliere (la sua solubilità), è una soluzione diluita;
2) Se la quantità di soluto è esattamente la stessa quantità della sua solubilità, è saturo;
3) Se c'è più soluto di quanto sia in grado di dissolversi, il soluto in eccesso si separa dalla soluzione.
Se questo processo di separazione include la cristallizzazione, forma un precipitato. La precipitazione riduce la concentrazione del soluto a saturazione per aumentare la stabilità della soluzione..
Le seguenti sono le regole di solubilità per solidi ionici comuni. Se due regole sembrano contraddirsi a vicenda, la precedente ha la precedenza.
1- Sali contenenti elementi del Gruppo I (Li+, N / A+, K+, Cs+, Rb+) sono solubili. Ci sono poche eccezioni a questa regola. Sali contenenti lo ione ammonio (NH4+) sono anche solubili.
2- Sali contenenti nitrato (NO3-) sono generalmente solubili.
3- I sali che contengono Cl -, Br - o I - sono generalmente solubili. Eccezioni importanti a questa regola sono i sali alogenuri di Ag+, Pb2+ e (Hg2)Due+. Pertanto, AgCl, PbBrDue e HgDueClDue sono insolubili.
4- La maggior parte dei sali d'argento sono insolubili. AgNO3 e Ag (CDueH3ODue) sono comuni sali solubili d'argento; Praticamente tutti gli altri sono insolubili.
5- La maggior parte dei sali solfati sono solubili. Eccezioni importanti a questa regola includono CaSO4, Baso4, PbSO4, AgDueSO4 e SrSO4.
6- La maggior parte dei sali idrossido sono solo leggermente solubili. I sali di idrossido degli elementi del gruppo I sono solubili. I sali idrossido degli elementi del gruppo II (Ca, Sr e Ba) sono leggermente solubili.
I sali idrossido di metalli di transizione e Al3 + sono insolubili. Quindi, Fe (OH)3, Al (OH)3, Co (OH)Due non sono solubili.
7- La maggior parte dei solfuri di metalli di transizione sono altamente insolubili, inclusi CdS, FeS, ZnS e AgDueS. Anche l'arsenico, l'antimonio, il bismuto e i solfuri di piombo sono insolubili.
8- I carbonati sono spesso insolubili. Carbonati del gruppo II (CaCO3, SrCO3 e BaCO3) sono insolubili, così come FeCO3 e PbCO3.
9- I cromati sono spesso insolubili. Gli esempi includono PbCrO4 e BaCrO4.
10- Fosfati come Ca3(PO4)Due e Ag3PO4 sono spesso insolubili.
11- Fluoruri come BaFDue, MgFDue e PbFDue sono spesso insolubili.
Esempi di solubilità in soluzioni acquose
Cola, acqua salata, pioggia, soluzioni acide, soluzioni di base e soluzioni saline sono esempi di soluzioni acquose. Quando si dispone di una soluzione acquosa, è possibile indurre un precipitato mediante reazioni di precipitazione.
Le reazioni di precipitazione sono talvolta chiamate reazioni di "doppio spostamento". Per determinare se si formerà un precipitato quando si mescolano soluzioni acquose di due composti:
- Registra tutti gli ioni in soluzione.
- Combinali (catione e anione) per ottenere tutti i potenziali precipitati.
- Utilizzare le regole di solubilità per determinare quale (se presente) combinazione (i) è insolubile e precipiterà.
Esempio 1: cosa succede quando Ba (NO3)Due (aq) e NaDueCO3 (aq)?
Ioni presenti in soluzione: BaDue+, NON3-, N / A+, CO3Due-
Potenziali precipitati: BaCO3, NaNO3
Regole di solubilità: BaCO3 è insolubile (regola 5), NaNO3 è solubile (regola 1).
Equazione chimica completa:
Bagno3)Due(aq) + NaDueCO3(aq) "BaCO3(s) + 2NaNO3 (aq)
Equazione ionica netta:
BaDue+(aq) + CO3Due-(aq) "BaCO3 (s)
Esempio 2: cosa succede quando Pb (NO3)Due (aq) e NH4Io (aq)?
Ioni presenti in soluzione: PbDue+, NON3-, NH4+, io-
Potenziali precipitati: PbIDue, NH4NON3
Regole di solubilità: PbIDue è insolubile (regola 3), NH4NON3 è solubile (regola 1).
Equazione chimica completa: Pb (NO3)2 (aq) + 2NH4io(aq) "PbI2 (s) + 2NH4NON3 (aq)
Equazione ionica netta: PbDue+(aq) + 2I-(aq) "PbI2 (s).
Riferimenti
- Anne Marie Helmenstine. (2017, 10 maggio). Definizione acquosa (soluzione acquosa). Recuperato da thoughtco.com.
- Anne Marie Helmenstine. (2017, 14 maggio). Definizione di soluzione acquosa in chimica. Recuperato da thoughtco.com.
- Antoinette Mursa, K. W. (2017, 14 maggio). Regole di solubilità. Recupero da chem.libretexts.org.
- Soluzione acquosa. (S.F.). Recupero da saylordotorg.github.io.
- Berkey, M. (2011, 11 novembre). Soluzioni acquose: definizione ed esempi. Recuperato da youtube.com.
- Reazioni in soluzione acquosa. (S.F.). Recupero da chemistry.bd.psu.edu.
- Reid, D. (S.F.). Soluzione acquosa: definizione, reazione ed esempio. Recupero da study.com.
- Solubilità. (S.F.). Recupero da chemed.chem.purdue.edu.



Nessun utente ha ancora commentato questo articolo.