
Cos'è la molalità? (con esempi)
Il molalità, denotato dalla lettera minuscola m, è un termine usato per descrivere la concentrazione di una soluzione. Può essere definito come il numero di moli di un soluto sciolto in 1 chilogrammo di solvente.
È uguale alle moli di soluto (la sostanza che si dissolve) divise per i chilogrammi di solvente (la sostanza usata per dissolversi).
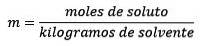
Dove le moli di soluto sono date dall'equazione:
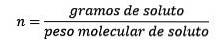
Quindi, alla fine, l'equazione della molalità è

Indice articolo
- 1 Caratteristiche della molalità
- 2 Differenze e somiglianze tra molalità (m) e molarità (M)
- 3 Esempi di molalità
- 3.1 Esempio 1:
- 3.2 Esempio 2:
- 3.3 Esempio 3:
- 4 Riferimenti
Caratteristiche della molalità
La molalità è una misura della concentrazione di un soluto in una soluzione. Utilizzato principalmente quando la temperatura è un problema.

La molalità non è comune come la sua controparte, la molarità (moli di soluto per litro di solvente), ma viene utilizzata in calcoli molto specifici, soprattutto per quanto riguarda le proprietà colligative (elevazione del punto di ebollizione, depressione del punto di ebollizione). Del congelamento).
Poiché il volume è soggetto a variazioni dovute alla temperatura e alla pressione, anche la molarità varia in base alla temperatura e alla pressione. In alcuni casi, l'uso del peso è un vantaggio perché la massa non varia con le condizioni ambientali..
È importante che venga utilizzata la massa del solvente e non la massa della soluzione. Le soluzioni etichettate con concentrazione molale sono indicate con una m minuscola. Una soluzione di 1,0 m contiene 1 mole di soluto per chilogrammo di solvente.
La preparazione di una soluzione di una data molalità è facile perché richiede solo una buona scala. Sia il solvente che il soluto vengono miscelati, anziché misurati in volume.
L'unità SI (Sistema Internazionale) per la molalità è mol / kg, o moli di soluto per kg di solvente. Una soluzione con una molalità di 1 mol / kg è spesso descritta come "1 molale" o "1 m".
Tuttavia, seguendo il sistema di unità SI, il National Institute of Standards and Technology, che è l'autorità degli Stati Uniti in materia di misurazione, considera il termine "molale" e il simbolo di unità "m" come obsoleti e suggerisce di utilizzare mol / kg.
Differenze e somiglianze tra molalità (m) e molarità (M)
La preparazione di una soluzione di una data molalità comporta la pesatura sia del soluto che del solvente e l'ottenimento delle loro masse..
Ma nel caso della molarità si misura il volume della soluzione, che lascia spazio a variazioni di densità dovute alle condizioni ambientali di temperatura e pressione..
Ciò significa che è vantaggioso lavorare con la molalità che si occupa della massa perché nella composizione chimica, la massa di una sostanza pura nota è più importante del suo volume poiché i volumi possono essere alterati per effetto della temperatura e della pressione mentre il la massa rimane invariata.
Inoltre, le reazioni chimiche avvengono in proporzione alla massa, non al volume. Per essere basata sulla massa, la molalità può essere facilmente convertita in un rapporto di massa o in una frazione di massa.
Per soluzioni acquose (soluzioni in cui l'acqua è il solvente) vicino alla temperatura ambiente, la differenza tra soluzioni molari e molari è trascurabile..
Questo perché intorno alla temperatura ambiente l'acqua ha una densità di 1 kg / L. Ciò significa che il "per L" di molarità è uguale al "per kg" di molalità..
Per un solvente come l'etanolo, dove la densità è 0,789 kg / l, una soluzione 1 M sarebbe 0,789 m.
La parte importante del ricordare la differenza è:
Molarità - M → moli per litro di soluzione.
Molalità - m → moli per chilogrammo di solvente.
Esempi di molalità
Esempio 1:
Problema: Qual è la molalità di una soluzione contenente 0,086 moli di NaCl disciolti in 25,0 g di acqua?
Risposta: Questo esempio utilizza l'equazione della molalità diretta:
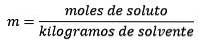
Moli di soluto (NaCl) = 0,086 mol
Massa (acqua) = 25,0 g = 25,0 x 10-3 kg
In sostituzione abbiamo:
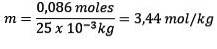
Esempio 2:
Problema: Qual è la molalità di una soluzione se 124,2 grammi di NaOH vengono sciolti in 1,00 litri di acqua? (La densità dell'acqua è pari a 1,00 g / ml).
Risposta: L'acqua è nota come solvente universale e la densità è solitamente indicata come 1,00 grammi per millilitro, o ciò che è uguale a 1 chilogrammo per litro. Ciò semplifica la conversione da litri a chilogrammi..
In questo problema i 124,2 grammi di NaOH dovranno essere convertiti in moli (per moli di soluto) e un litro d'acqua dovrà essere convertito in chilogrammi (per chilogrammo di solvente) utilizzando la densità.
Innanzitutto, trova la massa molare di NaOH:
P.MN / A= 22,99 g / mol
P.MO= 16 g / mol
P.MH= 1 g / mol
P.MNaOH= 22,99 g / mol +16 g / mol +1 g / mol = 39,99 g / mol
Secondo, converti i grammi di NaOH in moli, usando la massa molare:
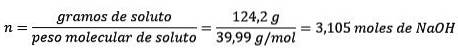
Terzo, converti il litro d'acqua in chilogrammi usando la densità.
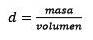
Risolvendo per la massa rimane
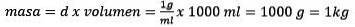
Alla fine l'equazione di molalità è risolta:
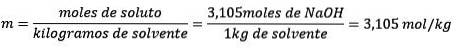
Esempio 3:
Problema: Qual è la massa d'acqua di una soluzione acquosa contenente 0,52 grammi di cloruro di bario (BaClDue, PM = 208,23 g / mol) la cui concentrazione è 0,005 mol / kg?
Risposta: in questo caso la concentrazione molale viene utilizzata per determinare la quantità di acqua in soluzione.
Innanzitutto, si ottiene il numero di moli di BaClDue nella soluzione:
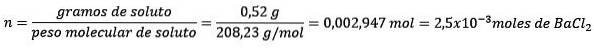
In secondo luogo, rimuovere chilogrammi di solvente dall'equazione di molalità e risolvere per.
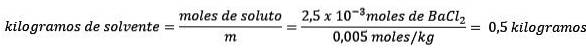
Riferimenti
- Appunti e progetti scientifici. (2015, 22 febbraio). Calcolo del problema di esempio della molalità. Estratto da sciencenotes.org.
- Bhardwaj, M. (2014, 26 novembre). Qual è un esempio di molalità? Recuperato da socratic.org.
- (S.F.). Molalità. Recuperato da boundless.com.
- Helmenstine, T. (2017, 19 febbraio). Qual è la differenza tra molalità e molalità? Recuperato da thoughtco.com.
- Formula di molalità. (S.F.). Recuperato da softschools.com.
- Molalità. (S.F.). Recuperato da chemteam.l
- Cos'è la molalità? (S.F.). Recupero da freechemistryonline.com.



Nessun utente ha ancora commentato questo articolo.