
Motivazioni, tecnica e usi del test della catalasi
Il test della catalasi è una metodologia utilizzata nei laboratori di batteriologia per rivelare la presenza dell'enzima catalasi in quei batteri che lo possiedono. Insieme alla colorazione di Gram, sono i principali test da eseguire sui microrganismi appena isolati. Questi test guidano il microbiologo sui passaggi da seguire per l'identificazione definitiva del microrganismo in questione..
In generale, i batteri contenenti citocromo possiedono l'enzima catalasi, il che significa che i batteri aerobici e anaerobici facoltativi dovrebbero possederlo. Tuttavia, ci sono delle eccezioni, come lo Streptococco, che nonostante siano microrganismi anaerobi facoltativi non hanno l'enzima catalasi.
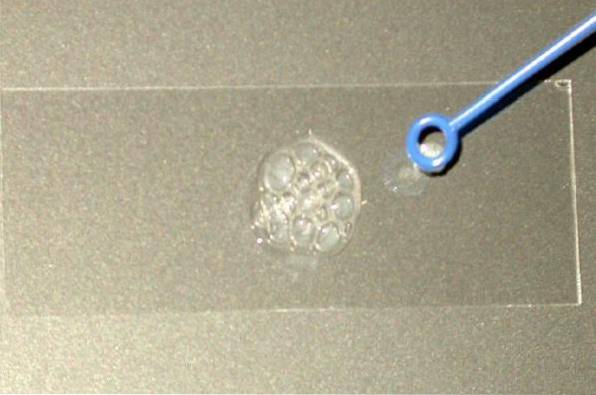
Ecco perché il test della catalasi viene utilizzato principalmente per distinguere le famiglie Staphylococaceae e Micrococaceae (entrambe catalasi positive) dalla famiglia Streptococaceae (catalasi negativa)..
Allo stesso modo, il genere Bacillus (catalasi positiva) si distingue dal genere Clostridium (catalasi negativa), tra gli altri.
Indice articolo
- 1 Razionale
- 2 Tecnica di routine per il test della catalasi
- 2.1 -Metodo di scorrimento
- 2.2 -Metodo diretto in coltura pura
- 2.3 -Metodo con tubo capillare o Fung e Petrishko
- 2.4 -Metodo Taylor e Achanzar per test catalasi che danno dubbi
- 3 Test della catalasi per le specie Mycobacterium
- 3.1 -Materiali
- 3.2 -Preparazione dei reagenti
- 3.3 -Procedura
- 4 Usa
- 5 Controllo di qualità
- 6 Limitazioni
- 7 Riferimenti
Base
La catalasi è un enzima classificato come idroperossidasi, questo significa che usano il perossido di idrogeno (HDueODue).
È anche considerato un'ossidoreduttasi, poiché nella reazione a cui partecipa c'è un elemento che funge da donatore di elettroni (sostanza riducente) e un altro da recettore di elettroni (sostanza ossidante).
La catalasi è una proteina che contiene un gruppo proserico con quattro atomi di ferro trivalenti (Fe+++), quindi è un'omoproteina. Lo ione ferrico rimane ossidato durante la reazione.
Si può dire che la catalasi è un enzima disintossicante, poiché la sua funzione è quella di eliminare le sostanze prodotte durante il metabolismo batterico che sono tossiche per i batteri. Tra queste sostanze c'è il perossido di idrogeno.
Il perossido di idrogeno si forma dalla scomposizione aerobica degli zuccheri. Questo processo si verifica come segue:
Lo ione superossido (ODue-) (radicale libero) si forma come prodotto finale dell'assimilazione del glucosio per via aerobica. Questo è tossico e viene eliminato dall'enzima superossido dismutasi che lo trasforma in ossigeno gassoso e perossido di idrogeno.
Il perossido di idrogeno è anche tossico per i batteri e deve essere rimosso. L'enzima catalasi scompone il perossido di idrogeno in acqua e ossigeno.
La catalasi può agire su substrati diversi dal perossido di idrogeno, come alcoli, aldeidi, acidi, ammine aromatiche e fenoli. Tuttavia, il perossido di idrogeno può anche essere utilizzato dalla catalasi per ossidare altri composti tossici come l'alcol metilico ed etilico..
Allo stesso modo, la catalasi è presente nelle cellule fagocitiche, proteggendola dall'azione tossica del perossido di idrogeno..
Tecnica di routine per il test della catalasi
-Metodo diapositiva
Materiali
Perossido di idrogeno al 3% (10 volumi).
Vetrino da microscopio
Manico in plastica usa e getta o stuzzicadenti in legno.
Processi
Prendi una quantità sufficiente della colonia per studiarla senza toccare l'agar da cui proviene. La colonia deve essere fresca, cioè da una cultura di 18 a 24 ore.
Posiziona la colonia sul vetrino asciutto e su di esso aggiungi una goccia di perossido di idrogeno al 3% (puoi anche usare HDueODue 30%). Osservare immediatamente se le bolle vengono rilasciate o meno.
Interpretazione
Reazione positiva: evoluzione del gas, evidenziata dalla formazione di bolle (forte gorgogliamento).
Reazione negativa: nessuna formazione di bolle.
-Metodo diretto in coltura pura
Mettere 1 ml di H.DueODue 3% su una piastra pura o su una coltura a cuneo che non contiene sangue (preferibilmente agar nutriente). Osservare se si formano immediatamente o meno bolle. Puoi anche usare H.DueODue 30%.
Viene interpretato allo stesso modo del metodo porta object.
-Tubo capillare o metodo Fung e Petrishko
Riempire un tubo capillare da 67 mm fino a un'altezza di 20 mm con perossido di idrogeno al 3% per capillarità.
Toccare la colonia isolata da studiare con il capillare pieno di H.DueODue alle 3%. Osservare se il capillare si riempie di bolle in circa 10 secondi. Questo metodo consente la semi-quantificazione della reazione in croci:
Nessuna croce, nessuna bolla (reazione negativa).
+ --Poche bolle (reazione debole o ritardata).
++ -Bolle abbondanti (reazione moderata).
+++ -Le bolle raggiungono l'estremo opposto (reazione energetica).
-Metodo di Taylor e Achanzar per prove di catalasi dubbiose
Su un vetrino pulito e asciutto, posizionare una colonia isolata, quindi posizionare una goccia di H.DueODue 0,5% e coprire con un coprioggetto. Osservare se si forma o meno la formazione di bolle intrappolate.
Interpretazione: la presenza di bolle indica una reazione positiva. Nessuna bolla, viene interpretata come una reazione negativa.
Test della catalasi per le specie Mycobacterium
Questa tecnica deve essere eseguita controllando il pH e la temperatura. Deve essere eseguito sotto cappa a flusso laminare, poiché la manipolazione delle diverse specie di Mycobacterium è pericolosa.
-Materiali
Perossido di idrogeno al 30% o 110 volumi (superossale).
Tampone fosfato pH 7
10% Tween 80
Mycobacterium wedge culture per 3-4 settimane
-Preparazione a partire dal reagenti
Tampone fosfato pH 7
Pesare:
1,361 g (KHDuePO4) fosfato monopotassico anidro.
1.420 g di fosfato disodico anidro (Na2HPO3).
Sciogliere entrambi i sali in poca acqua distillata sterile e portare a 1000 ml con acqua.
10% Tween 80
Diluire 1:10 il Tween 80 commercialmente concentrato, per fare ciò procedere come segue:
Prendete 1 ml di Tween 80 e mettetelo in poca acqua distillata, scioglietelo e quindi portate a volume con acqua fino a 10 ml.
Reagente finale
Mescolare una quantità di tampone fosfato con una quantità di Tween 80 al 10% (in parti uguali). Definisci in laboratorio quanto vuoi preparare.
-Processi
Mettere 5 ml di tampone fosfato in una provetta sterile con tappo a vite (bachelite).
Con un'ansa di inoculazione, prendere una quantità sufficiente di colonia di una crescita di Mycobacterium seminata a spicchi e scioglierla nel tampone fosfato.
Tappare il tubo senza stringere eccessivamente la filettatura. Mettere a bagnomaria a 68 ° C per 20-30 minuti. Rimuovere e raffreddare a 22-25 ° C
Misurare 0,5 ml del reagente finale (miscela) e aggiungerlo alla provetta con la soluzione fredda. Osservare la formazione o meno di bolle.
Viene interpretato come le tecniche precedenti.
Uso
Quando si ottiene la crescita delle colonie in terreni arricchiti, è necessario eseguire una colorazione di Gram e un test della catalasi sulle colonie ottenute. Questo guiderà il microbiologo sulle procedure da seguire per l'identificazione definitiva..

QA
Per valutare le buone prestazioni del reagente al perossido di idrogeno, utilizzare ceppi di controllo appena coltivati, come Staphylococcus aureus come controllo positivo e ceppi di Streptococcus sp come controllo negativo.
Un'altra alternativa che funge da controllo positivo è quella di posizionare una goccia di perossido di idrogeno sull'agar sangue, gli eritrociti hanno catalasi, quindi, ci sarà un gorgoglio se il reagente è in buone condizioni.
Un agar cioccolato può essere utilizzato come controllo negativo, qui gli eritrociti sono già lisati e il test è negativo.
Limitazioni
-Non utilizzare vecchie colture per il test, poiché ciò può portare a falsi negativi.
-Evitare di prelevare colonie da colture di agar sangue, se si fa attenzione a non toccare l'agar; questa procedura può portare a falsi positivi, poiché gli eritrociti contengono catalasi.
-Se prendi l'acqua di colonia ad anello in platino, non invertire l'ordine della procedura in quanto ciò può portare a falsi positivi. Questo perché il platino è in grado di reagire con il perossido di idrogeno, provocando un gorgoglio..
-Non utilizzare il reagente al perossido di idrogeno se è molto vecchio, poiché il reagente è molto instabile e tende a degradarsi nel tempo..
-Conservare il reagente al perossido di idrogeno al riparo dalla luce e in frigorifero per evitare danni..
-Eseguire un controllo di qualità sul reagente al perossido di idrogeno ogni volta che viene utilizzato.
-Tieni presente che se l'HDueODue al 30% le reazioni sono più forti di quelle effettuate con HDueODue alle 3%.
Riferimenti
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosi microbiologica. 5a ed. Editoriale Panamericana S.A. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Editoriale Panamericana S.A. Argentina.
- Mac Faddin J. (2003). Test biochimici per l'identificazione di batteri di importanza clinica. 3a ed. Editoriale Panamericana. Buenos Aires. Argentina.
- BD Laboratories. Reagente catalasi-Gotario. Disponibile su: http://winklerltda.cl
- Vadequímica Laboratories. Perossido. Equivalenza tra volumi e percentuale. Disponibile su: vadequimica.com


Nessun utente ha ancora commentato questo articolo.