
Cos'è un diagramma energetico? (con esempi)

UN diagramma energetico è un grafico dell'energia che illustra il processo che si verifica durante una reazione. I diagrammi energetici possono anche essere definiti come la visualizzazione di una configurazione elettronica in orbitali; ogni rappresentazione è un elettrone proveniente da un orbitale con una freccia.
Ad esempio, in un diagramma di energia le frecce che puntano verso l'alto rappresentano un elettrone con uno spin positivo. A loro volta, le frecce rivolte verso il basso sono responsabili della rappresentazione di un elettrone con spin negativo.
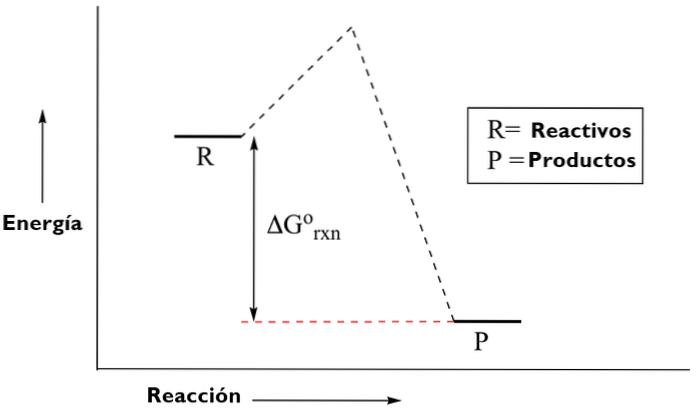
Esistono due tipi di diagrammi energetici. I diagrammi della termodinamica o chimica organica, che mostrano la quantità di energia generata o spesa durante una reazione; a partire dagli elementi reattivi, passando per uno stato di transizione, ai prodotti.
E diagrammi di chimica inorganica, che servono a dimostrare gli orbitali molecolari in base al livello di energia degli atomi.
Tipi di diagrammi energetici
Diagrammi termodinamici
I diagrammi termodinamici sono diagrammi utilizzati per rappresentare gli stati termodinamici di una materia (tipicamente fluidi) e le conseguenze della manipolazione di questo materiale.
Ad esempio, un diagramma della temperatura entropica può essere utilizzato per dimostrare il comportamento di un fluido mentre cambia attraverso un compressore..
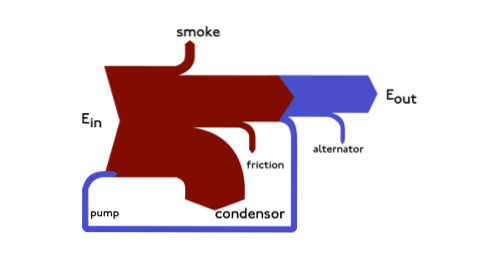
I diagrammi di Sankey sono diagrammi energetici in cui lo spessore delle frecce viene mostrato proporzionalmente alla quantità di flusso. Un esempio può essere illustrato come segue:
Questo diagramma rappresenta l'intero flusso primario di energia in una fabbrica. Lo spessore delle cinghie è direttamente proporzionale all'energia di produzione, utilizzo e perdite.
Le fonti primarie di energia sono gas, elettricità e carbone / petrolio e rappresentano l'ingresso di energia sul lato sinistro del diagramma..
È inoltre possibile visualizzare le spese energetiche, il flusso di materiali a livello regionale o nazionale e la ripartizione del costo di un articolo o di un servizio..
Questi diagrammi pongono un'enfasi visiva su grandi trasferimenti o flussi di energia all'interno di un sistema..
E sono molto utili per individuare i contributi dominanti in un flusso generale. Questi diagrammi mostrano spesso quantità conservate entro i limiti di un sistema definito..
Diagramma P-V
Viene utilizzato per descrivere i cambiamenti corrispondenti alle misurazioni di volume e pressione nel sistema. Sono comunemente usati in termodinamica, fisiologia cardiovascolare e fisiologia respiratoria..
I diagrammi P-V erano originariamente chiamati diagrammi degli indicatori. Sono stati sviluppati nel XVIII secolo come strumenti per comprendere l'efficienza dei motori a vapore..
Un diagramma P-V mostra la variazione della pressione P rispetto al volume di V di alcuni processi.
In termodinamica, questi processi formano un ciclo, in modo che quando il ciclo è completato non vi è alcun cambiamento nello stato del sistema; come ad esempio in un apparecchio che ritorna alla sua pressione e volume iniziali.
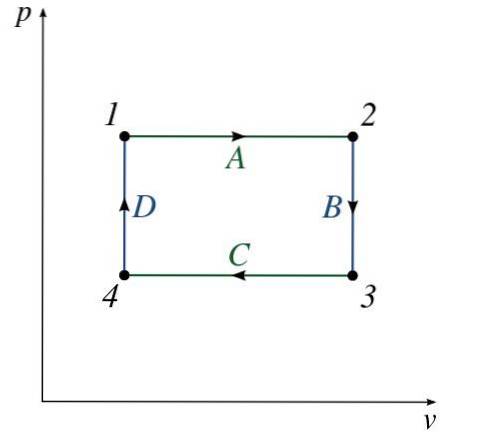
La figura mostra le caratteristiche di un tipico diagramma P-V. È possibile osservare una serie di stati numerati (da 1 a 4).
Il percorso tra ogni stato consiste in un processo (da A a D) che altera la pressione o il volume del sistema (O entrambi).
Diagramma T-S
Viene utilizzato in termodinamica per visualizzare i cambiamenti di temperatura e l'entropia specifica durante un processo o ciclo termodinamico..
È molto utile e uno strumento molto comune nella zona, in particolare perché aiuta a visualizzare il trasferimento di calore durante un processo..
Per processi reversibili o ideali, l'area sotto la curva T-S di un processo è il calore trasferito al sistema durante quel processo..
Un processo isotropico è rappresentato graficamente come una linea verticale su un diagramma T-S, mentre un processo isotermico è rappresentato graficamente come una linea orizzontale..
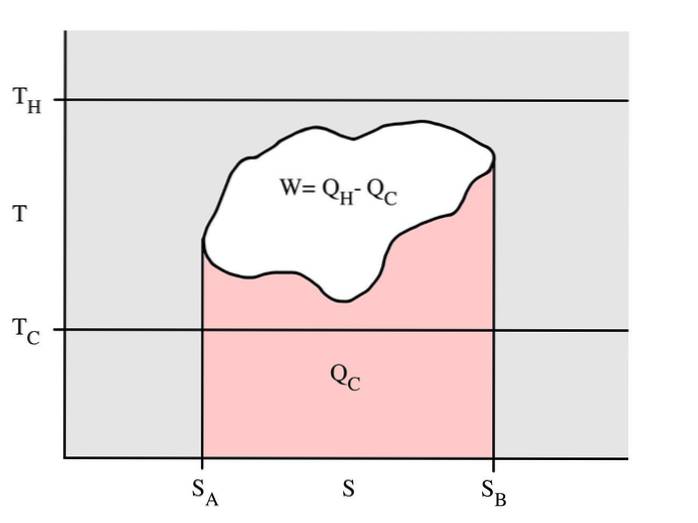
Questo esempio mostra un ciclo termodinamico che si svolge a una temperatura del serbatoio caldo Tc e una temperatura del serbatoio freddo Tc. In un processo reversibile, l'area rossa Qc è la quantità di energia scambiata tra il sistema e il serbatoio freddo.
L'area vuota W è la quantità di lavoro energetico scambiato tra il sistema e l'ambiente circostante. La quantità di calore Qh scambiata tra il serbatoio caldo è la somma dei due.
Se il ciclo si sposta a destra significa che è un motore termico che rilascia lavoro. Se il ciclo si muove in senso inverso, è una pompa di calore che riceve lavoro e sposta il calore Qh dal bollitore freddo al bollitore caldo.
Diagrammi di chimica inorganica
Servono a rappresentare o schematizzare gli orbitali molecolari relativi agli atomi e al loro livello di energia.
Diagramma di energia potenziale dell'etano
Le diverse conformazioni dell'etano non avranno la stessa energia poiché hanno una diversa repulsione elettronica tra gli idrogeni.
Man mano che la molecola viene ruotata, a partire da una conformazione già sfalsata, la distanza tra gli atomi di idrogeno dei particolari gruppi metilici inizia a ridursi. L'energia potenziale di quel sistema aumenterà fino a raggiungere una conformazione eclissata.
I diversi tipi di energia tra le varie conformazioni possono essere rappresentati graficamente. Nel diagramma dell'etano si osserva come le conformazioni eclissate siano la massima energia; d'altra parte i supplenti sarebbero il minimo.
In questo diagramma dell'energia potenziale, l'etano parte da una conformazione eclissata. Quindi fanno giri da 60 ° a 60 ° fino a coprire i 360 °.
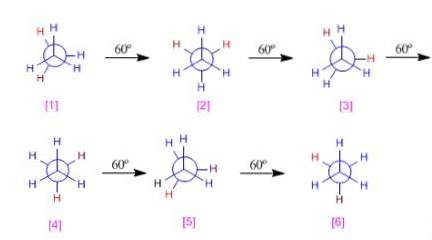
Le diverse conformazioni possono essere classificate in base all'energia. Ad esempio, le alternative 1,3 e 5 hanno la stessa energia (0). D'altra parte, le conformazioni 2,4 e 6 avranno più energia come conseguenza dell'eclissi di idrogeno-idrogeno
Riferimenti
- Diagramma del volume di pressione. Estratto da wikipedia.org
- Diagramma T-S. Estratto da wikipedia.org
- Diagramma di Sankey. Estratto da wikipedia.org
- Diagrammi di energia potenziale. (2009). Recupero da quimicaorganica.net


Nessun utente ha ancora commentato questo articolo.