
Polarità (chimica) molecole polari ed esempi
Il polarità chimica è una proprietà caratterizzata dalla presenza di una marcata distribuzione eterogenea delle densità di elettroni in una molecola. Nella sua struttura, quindi, ci sono regioni caricate negativamente (δ-), e altre caricate positivamente (δ +), che generano un momento di dipolo.
Il momento di dipolo di legame (µ) è un modo per esprimere la polarità di una molecola. Di solito è rappresentato come un vettore la cui origine è nella carica (+) e la sua estremità si trova nella carica (-), sebbene alcuni chimici lo rappresentino inversamente.
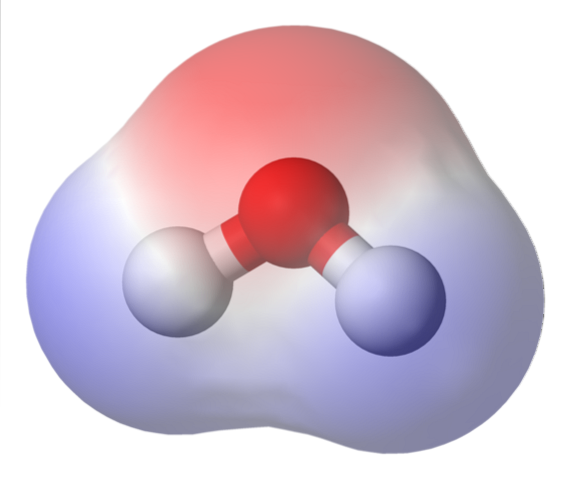
L'immagine in alto mostra la mappa del potenziale elettrostatico per l'acqua, H.DueO. La regione rossastra (atomo di ossigeno) corrisponde a quella con la più alta densità di elettroni e si può anche vedere che spicca sulle regioni blu (atomi di idrogeno).
Poiché la distribuzione di questa densità elettronica è eterogenea, si dice che esiste un polo positivo e uno negativo. Ecco perché si parla di "polarità" chimica e momento di dipolo.
Indice articolo
- 1 momento di dipolo
- 1.1 Asimmetria nella molecola d'acqua
- 2 molecole polari
- 3 esempi
- 3.1 SO2
- 3.2 CHCl3
- 3.3 HF
- 3.4 NH3
- 3.5 Macromolecole con eteroatomi
- 4 Riferimenti
Momento di dipolo
Il momento di dipolo µ è definito dalla seguente equazione:
µ = δd
Dove δ è la carica elettrica di ciascun polo, positiva (+ δ) o negativa (-δ), e d è la distanza tra loro.
Il momento di dipolo è solitamente espresso in debye, rappresentato dal simbolo D. Un coulomb · metro è uguale a 2.998 · 1029 D.
Il valore del momento di dipolo del legame tra due diversi atomi è in relazione alla differenza di elettronegatività degli atomi che formano il legame..
Perché una molecola sia polare, non è sufficiente avere legami polari nella sua struttura, ma deve anche avere una geometria asimmetrica; in modo tale da evitare che i momenti di dipolo annullino i vettori l'uno dell'altro.
Asimmetria nella molecola d'acqua
La molecola d'acqua ha due legami O-H. La geometria della molecola è angolare, cioè a forma di "V"; quindi i momenti di dipolo dei legami non si annullano a vicenda, ma piuttosto la somma di essi viene prodotta puntando verso l'atomo di ossigeno.
La mappa del potenziale elettrostatico per H.DueO rifletti questo.
Se si osserva la molecola angolare H-O-H, può sorgere la seguente domanda: è davvero asimmetrica? Se un asse immaginario viene disegnato attraverso l'atomo di ossigeno, la molecola si dividerà in due metà uguali: H-O | O-H.
Ma non è così se l'asse immaginario è orizzontale. Quando questo asse ora divide di nuovo la molecola in due metà, avremo l'atomo di ossigeno su un lato e i due atomi di idrogeno sull'altro..
Per questo motivo l'apparente simmetria dell'HDueOppure cessa di esistere, ed è quindi considerata una molecola asimmetrica.
Molecole polari
Le molecole polari devono soddisfare una serie di caratteristiche, come ad esempio:
-La distribuzione delle cariche elettriche nella struttura molecolare è asimmetrica.
-Di solito sono solubili in acqua. Questo perché le molecole polari possono interagire per forze dipolo-dipolo, dove l'acqua è caratterizzata da un grande momento di dipolo.
Inoltre, la sua costante dielettrica è molto elevata (78,5), il che gli consente di mantenere separate le cariche elettriche aumentandone la solubilità..
-In generale, le molecole polari hanno punti di ebollizione e fusione elevati.
Queste forze sono costituite dall'interazione dipolo-dipolo, dalle forze dispersive di Londra e dalla formazione di legami idrogeno..
-A causa della loro carica elettrica, le molecole polari possono condurre elettricità.
Esempi
SWDue
Anidride solforosa (SODue). L'ossigeno ha un'elettronegatività di 3,44, mentre l'elettronegatività dello zolfo è 2,58. Pertanto, l'ossigeno è più elettronegativo dello zolfo. Ci sono due legami S = O, O avente carica δ- e S a δ carica+.
Poiché è una molecola angolare con S al vertice, i due momenti di dipolo sono orientati nella stessa direzione; e quindi, si sommano, formando la molecola SODue essere polare.
CHCl3
Cloroformio (HCCl3). C'è un legame C-H e tre legami C-Cl.
L'elettronegatività di C è 2,55 e l'elettronegatività di H è 2,2. Pertanto, il carbonio è più elettronegativo dell'idrogeno; e quindi, il momento di dipolo sarà orientato da H (δ +) verso C (δ-): Cδ--Hδ+.
Nel caso dei legami C-Cl, C ha un'elettronegatività di 2,55, mentre Cl ha un'elettronegatività di 3,16. Il vettore di dipolo o momento di dipolo è orientato da C verso Cl nei tre legami C. δ+-Cl δ-.
Poiché esiste una regione povera di elettroni, attorno all'atomo di idrogeno, e una regione ricca di elettroni composta dai tre atomi di cloro, CHCl3 è considerata una molecola polare.
HF
Il fluoruro di idrogeno ha un solo legame H-F. L'elettronegatività di H è 2,22 e l'elettronegatività di F è 3,98. Pertanto, il fluoro finisce con la più alta densità di elettroni e il legame tra entrambi gli atomi è meglio descritto come: H.δ+-Fδ-.
NH3
Ammoniaca (NH3) ha tre legami N-H. L'elettronegatività di N è 3.06 e l'elettronegatività di H è 2.22. In tutti e tre i legami, la densità elettronica è orientata verso l'azoto, essendo ancora più elevata per la presenza di una coppia di elettroni liberi.
La molecola NH3 è tetraedrico, con l'atomo di N che occupa il vertice. I tre momenti di dipolo, corrispondenti ai legami N-H, sono orientati nella stessa direzione. In essi, δ- si trova nella N e δ + nell'H. Quindi i legami sono: Nδ--Hδ+.
Questi momenti di dipolo, l'asimmetria della molecola e la coppia libera di elettroni sull'azoto, rendono l'ammoniaca una molecola altamente polare..
Macromolecole con eteroatomi
Quando le molecole sono molto grandi, non è più certo di classificarle come apolari o polari esse stesse. Questo perché ci possono essere parti della sua struttura con caratteristiche sia apolari (idrofobiche) che polari (idrofile)..
Questi tipi di composti sono noti come anfifili o anfipatici. Poiché la parte apolare può essere considerata povera di elettroni rispetto alla parte polare, nella struttura è presente una polarità e i composti anfifilici sono considerati composti polari..
Ci si può generalmente aspettare che una macromolecola con eteroatomi abbia momenti di dipolo e quindi polarità chimica..
Gli eteroatomi sono quelli che sono diversi da quelli che compongono lo scheletro della struttura. Ad esempio, lo scheletro di carbonio è biologicamente il più importante di tutti e l'atomo con cui il carbonio forma un legame (oltre all'idrogeno) è chiamato eteroatomo..
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Prof. Krishnan. (2007). Composti polari e non polari. St. Louis Community College. Recupero da: users.stlcc.edu
- Murmson, Serm. (14 marzo 2018). Come spiegare la polarità. Scienza. Estratto da: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (5 dicembre 2018). Definizione ed esempi di legame polare (legame covalente polare). Estratto da: thoughtco.com
- Wikipedia. (2019). Polarità chimica. Estratto da: en.wikipedia.org
- Quimitube. (2012). Legame covalente: polarità del legame e polarità molecolare. Estratto da: quimitube.com



Nessun utente ha ancora commentato questo articolo.