
Struttura, proprietà e usi del perossido di bario (BaO2)

Il perossido di bario è un composto ionico e inorganico la cui formula chimica è BaODue. Essendo un composto ionico, è costituito da ioni BaDue+ meDueDue-; quest'ultimo è ciò che è noto come l'anione perossido e, a causa di esso, il BaODue acquisisce il suo nome. Stando così le cose, il BaODue è un perossido inorganico.
Le cariche dei suoi ioni rivelano come questo composto è formato dagli elementi. Il metallo di bario del gruppo 2 fornisce due elettroni alla molecola di ossigeno, ODue, i cui atomi non sono usati per ridursi ad anioni di ossido, ORDue-, ma per essere tenuti insieme da un semplice collegamento, [O-O]Due-.

Il perossido di bario è un solido granulare a temperatura ambiente, di colore bianco con lievi sfumature grigiastre (immagine in alto). Come quasi tutti i perossidi, va maneggiato e conservato con cura, poiché può accelerare l'ossidazione di alcune sostanze.
Di tutti i perossidi formati dai metalli del gruppo 2 (Mr. Becambara), BaODue è termodinamicamente il più stabile contro la sua decomposizione termica. Quando riscaldato, rilascia ossigeno e viene prodotto ossido di bario, BaO. BaO può reagire con l'ossigeno nell'ambiente, ad alte pressioni, per formare nuovamente BaODue.
Indice articolo
- 1 Struttura
- 1.1 Energia del reticolo cristallino
- 1.2 Idrata
- 2 Preparazione o sintesi
- 3 Proprietà
- 3.1 Aspetto fisico
- 3.2 Massa molecolare
- 3.3 Densità
- 3.4 Punto di fusione
- 3.5 Punto di ebollizione
- 3.6 Solubilità in acqua
- 3.7 Decomposizione termica
- 4 Nomenclatura
- 5 Usi
- 5.1 Produttore di ossigeno
- 5.2 Produttore di perossido di idrogeno
- 6 Riferimenti
Struttura
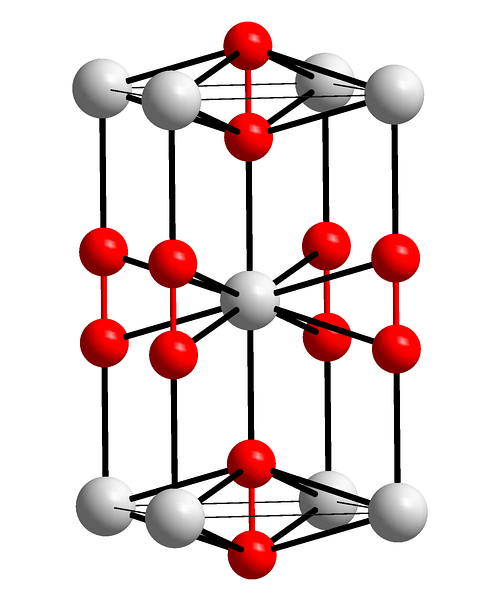
L'immagine in alto mostra la cellula unitaria tetragonale del perossido di bario. Al suo interno si possono vedere i cationi BaDue+ (sfere bianche) e gli anioni ODueDue- (sfere rosse). Nota che le sfere rosse sono unite da un unico legame, quindi rappresentano la geometria lineare [O-O]Due-.
Da questa cella unitaria è possibile costruire cristalli BaODue. Se osservato, l'anione ODueDue- si vede che è circondato da sei BaDue+, ottenendo un ottaedro i cui vertici sono bianchi.
D'altra parte, ancora più evidente, ogni BaDue+ è circondato da dieci ODueDue- (sfera bianca al centro). Tutto il cristallo consiste in questo ordine costante a breve e lungo raggio.
Energia del reticolo cristallino
Se si osservano anche le sfere bianche rosse, si noterà che non differiscono troppo nelle dimensioni o nei raggi ionici. Questo perché il Ba cationDue+ è molto voluminoso e le sue interazioni con l'anione ODueDue- stabilizzare l'energia del reticolo del cristallo a un grado migliore rispetto a come farebbero, ad esempio, i cationi CaDue+ e MgDue+.
Questo spiega anche perché BaO è il più instabile degli ossidi alcalino terrosi: gli ioni Ba.Due+ meDue- differiscono notevolmente per dimensioni, destabilizzando i loro cristalli.
Poiché è più instabile, minore è l'andamento di BaODue decomponendosi per formare BaO; contrariamente ai perossidi SrODue, CaODue e MgODue, i cui ossidi sono più stabili.
Idrata
Il BaODue si trova sotto forma di idrati, di cui BaODue∙ 8HDueOppure è il più stabile di tutti; e infatti, questo è quello che viene commercializzato, al posto del perossido di bario anidro. Per ottenere quello anidro, il BaO deve essere essiccato a 350 ° CDue∙ 8HDueOppure, allo scopo di rimuovere l'acqua.
Anche la sua struttura cristallina è tetragonale, ma con otto molecole di H.DueO interagendo con l'ODueDue- attraverso legami idrogeno e con il BaDue+ per interazioni dipolo-ione.
Altri idrati, delle cui strutture non si hanno molte informazioni al riguardo, sono: BaODue∙ 10HDueO, BaODue∙ 7HDueO e BaODue∙ H.DueO.
Preparazione o sintesi
La preparazione diretta del perossido di bario consiste nell'ossidazione del suo ossido. Questo può essere utilizzato dalla barite minerale o dal sale di nitrato di bario, Ba (NO3)Due; entrambi sono riscaldati in un'atmosfera arricchita di aria o ossigeno.
Un altro metodo consiste nel far reagire Ba (NO3)Due con perossido di sodio:
Bagno3)Due + N / ADueODue + xHDueO => BaODue∙ xHDueO + 2 NaNO3
Quindi l'idrato BaODue∙ xHDueOppure si sottopone a riscaldamento, si filtra e si rifinisce mediante essiccazione sottovuoto.
Proprietà
Aspetto fisico
È un solido bianco che può diventare grigiastro se ha impurità (BaO, Ba (OH)Due, o altre specie chimiche). Se viene riscaldato a una temperatura molto elevata, emetterà fiamme verdastre, a causa delle transizioni elettroniche delle ba cazioni.Due+.
Massa molecolare
169,33 g / mol.
Densità
5,68 g / mL.
Punto di fusione
450 ° C.
Punto di ebollizione
800 ° C. Questo valore è coerente con quello che ci si dovrebbe aspettare da un composto ionico; e ancora di più, del perossido alcalino terroso più stabile. Tuttavia, il BaO non bolle davveroDue, piuttosto, l'ossigeno gassoso viene rilasciato come risultato della sua decomposizione termica.
Solubilità dell'acqua
Insolubile. Tuttavia, può subire lentamente idrolisi per produrre perossido di idrogeno, H.DueODue; e inoltre, la sua solubilità in mezzo acquoso aumenta se viene aggiunto un acido diluito.
Decomposizione termica
La seguente equazione chimica mostra la reazione di decomposizione termica che BaO subisceDue:
2BaODue <=> 2BaO + ODue
La reazione è unidirezionale se la temperatura è superiore a 800 ° C. Se la pressione viene immediatamente aumentata e la temperatura diminuisce, tutto il BaO verrà ritrasformato in BaODue.
Nomenclatura
Un altro modo per chiamare il BaODue è perossido di bario, secondo la nomenclatura tradizionale; poiché il bario può avere solo la valenza +2 nei suoi composti.
A torto, la nomenclatura sistematica viene utilizzata per riferirsi ad esso come biossido di bario (binoossido), considerandolo un ossido e non un perossido.
Applicazioni
Produttore di ossigeno
Utilizzando la barite minerale (BaO), viene riscaldato con correnti d'aria per eliminarne il contenuto di ossigeno, ad una temperatura di circa 700 ° C..
Se il perossido risultante viene riscaldato delicatamente sotto vuoto, l'ossigeno viene rigenerato più rapidamente e la barite può essere riutilizzata indefinitamente per immagazzinare e produrre ossigeno..
Questo processo è stato ideato commercialmente da L. D. Brin, ora obsoleto.
Produttore di perossido di idrogeno
Il perossido di bario reagisce con l'acido solforico per produrre perossido di idrogeno:
FascioDue + HDueSW4 => HDueODue + Baso4
È quindi una fonte di H.DueODue, manipolato soprattutto con il suo idrato BaODue∙ 8HDueO.
Secondo questi due usi citati, il BaODue consente lo sviluppo di ODue e H.DueODue, sia agenti ossidanti, nella sintesi organica che nei processi di sbiancamento nell'industria tessile e tintoria. È anche un buon agente disinfettante..
Inoltre, da BaODue altri perossidi possono essere sintetizzati, come sodio, NaDueODue, e altri sali di bario.
Riferimenti
- S.C. Abrahams, J Kalnajs. (1954). La struttura cristallina del perossido di bario. Laboratorio per la ricerca sull'isolamento, Massachusetts Institute of Technology, Cambridge, Massachusetts, USA.
- Wikipedia. (2018). Perossido di bario. Estratto da: en.wikipedia.org
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Atomistry. (2012). Perossido di bario. Estratto da: barium.atomistry.com
- Khokhar et al. (2011). Studio della preparazione di bilance da laboratorio e sviluppo di un processo per il perossido di bario. Estratto da: academia.edu
- PubChem. (2019). Perossido di bario. Estratto da: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Preparazione del perossido di bario. Estratto da: prepchem.com

Nessun utente ha ancora commentato questo articolo.