
Caratteristiche del modello atomico di Bohr, postulati, limitazioni

Il Modello atomico di Bohr è la concezione della struttura dell'atomo del fisico danese Niels Bohr (1885-1962), pubblicata nel 1913. Nell'atomo di Bohr, gli elettroni attorno al nucleo occupano solo determinate orbite consentite, grazie a una restrizione chiamata quantizzazione.
Per Bohr, l'immagine dell'atomo come un sistema solare in miniatura, con elettroni in orbita attorno al nucleo, non era del tutto coerente con il fatto che le cariche elettriche, quando accelerate, irradiano energia..
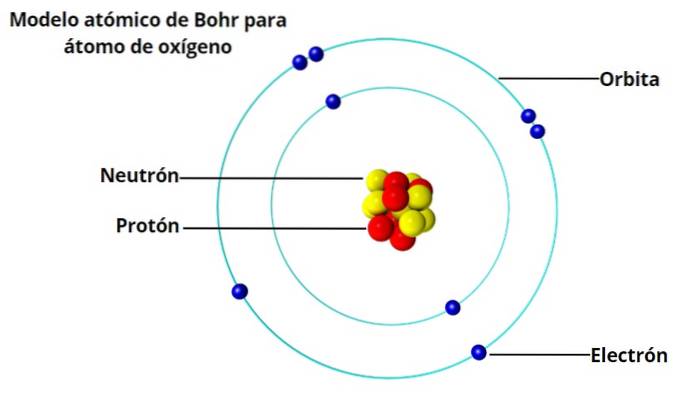
Un atomo del genere non sarebbe stabile, perché prima o poi finirebbe per collassare perché gli elettroni andrebbero a spirale verso il nucleo. E a quel punto, i caratteristici schemi di luce che l'idrogeno e altri gas emettono quando riscaldati erano noti da 50 anni..
Il modello o spettro è costituito da una serie di linee luminose di determinate lunghezze d'onda molto specifiche. E l'atomo di idrogeno non collassa emettendo luce.
Per spiegare perché l'atomo è stabile nonostante sia in grado di irradiare energia elettromagnetica, Bohr ha proposto che il momento angolare potrebbe adottare solo determinati valori, e quindi anche energia. Questo è ciò che si intende per quantizzazione.
Accettando che l'energia fosse quantizzata, l'elettrone avrebbe la stabilità necessaria per non precipitarsi verso il nucleo distruggendo l'atomo..
E l'atomo irradia energia luminosa solo quando l'elettrone passa da un'orbita all'altra, sempre in quantità discrete. In questo modo, viene spiegata la presenza di modelli di emissione nell'idrogeno..
Bohr compose così una visione dell'atomo integrando concetti familiari della meccanica classica con quelli scoperti di recente, come la costante di Planck, il fotone, l'elettrone, il nucleo atomico (Rutherford era stato il mentore di Bohr) e gli spettri di emissione summenzionati..
Indice articolo
- 1 Caratteristiche principali del modello Bohr
- 1.1 Calcolo del raggio dell'orbita dell'elettrone
- 2 Postulati del modello atomico di Bohr
- 2.1 Gli elettroni descrivono percorsi circolari
- 2.2 Il momento angolare è quantizzato
- 2.3 Gli elettroni emettono o assorbono fotoni quando passano da uno stato energetico a un altro
- 3 Limitazioni
- 4 Articoli di interesse
- 5 Riferimenti
Caratteristiche principali del modello Bohr
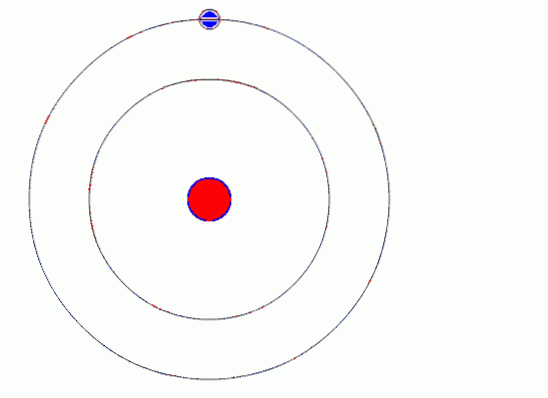
Il modello atomico di Bohr presuppone che l'elettrone si muova in un'orbita circolare attorno al nucleo per l'azione della forza di attrazione elettrostatica di Coulomb e propone che il momento angolare dell'elettrone sia quantizzato.
Vediamo come integrare entrambi i concetti in forma matematica:
Sia L l'ampiezza del momento angolare, m la massa dell'elettrone, v la velocità dell'elettrone er il raggio dell'orbita. Per calcolare L abbiamo:
L = m⋅r⋅v
Bohr ha proposto che L fosse uguale a multipli interi della costante h / 2π, dove h è il La costante di Planck, introdotto poco tempo fa dal fisico Max Planck (1858-1947) nel risolvere il problema dell'energia emessa da un corpo nero, oggetto teorico che assorbe tutta la luce incidente.
Il suo valore è h = 6,626 × 10−34 J ・ s, mentre a h / 2π è indicato come ħ, ciò che viene letto "H bar".
Pertanto, il momento angolare L rimane:
m⋅r⋅v = nħ, con n = 1,2, 3 ...
E da questa condizione si deducono i raggi delle orbite consentiti per l'elettrone, come vedremo in seguito.
Calcolo del raggio dell'orbita dell'elettrone
In quanto segue assumeremo il più semplice degli atomi: l'idrogeno, che consiste in un unico protone e un elettrone, entrambi con carica di magnitudine e.
La forza centripeta che mantiene l'elettrone nella sua orbita circolare è fornita dall'attrazione elettrostatica, la cui grandezza F è:
F = keDue/ rDue
Dove k è la costante elettrostatica della legge di Coulomb er la distanza elettrone-protone. Sapendo che in un movimento circolare l'accelerazione centripeta ac è dato dal rapporto tra il quadrato della velocità e la distanza r:
perc = vDue / r
Secondo la seconda legge di Newton, la forza netta è il prodotto della massa me dell'accelerazione:
mvDue/ r = keDue/ rDue
Semplificando il raggio r, otteniamo:
m⋅vDuer = keDue
Combinando questa espressione con quella di momento angolare abbiamo un sistema di equazioni, dato da:
1) mvDuer = keDue
2) r = n ħ/ mv
L'idea è di risolvere il sistema e determinare r, il raggio dell'orbita consentita. Un po 'di algebra elementare porta alla risposta:
r = (nħ)Due / k⋅m⋅eDue
Con n = 1, 2, 3, 4, 5 ...
Per n = 1 abbiamo il più piccolo dei raggi, chiamato Raggio di Bohr ao con un valore di 0,529 × 10−10 m. I raggi delle altre orbite sono espressi in termini di pero.
In questo modo Bohr introduce il numero quantico principale n, notando che i raggi consentiti sono una funzione della costante di Planck, della costante elettrostatica e della massa e della carica dell'elettrone.
Il modello atomico di Bohr postula

Bohr combina abilmente la meccanica newtoniana con nuove scoperte che si sono verificate continuamente durante la seconda metà del diciannovesimo e l'inizio del ventesimo secolo. Tra questi il rivoluzionario concetto di "quantum", di cui lo stesso Planck sosteneva di non essere molto convinto.
Attraverso la sua teoria, Bohr è stato in grado di spiegare in modo soddisfacente le serie nello spettro dell'idrogeno e prevedere le emissioni di energia nella gamma dell'ultravioletto e dell'infrarosso, che non erano ancora state osservate..
Possiamo riassumere i suoi postulati come segue:
Gli elettroni descrivono percorsi circolari
L'elettrone ruota attorno al nucleo in un'orbita circolare stabile, con movimento circolare uniforme. Il movimento è dovuto all'attrazione elettrostatica che il nucleo esercita su di esso.
Il momento angolare è quantizzato
Il momento angolare dell'elettrone è quantizzato secondo l'espressione:
L = mvr = nħ
Dove n è un numero intero: n = 1, 2, 3, 4 ..., il che porta al fatto che l'elettrone può trovarsi solo in certe orbite definite, i cui raggi sono:
r = (n ħ)Due / k m eDue
Gli elettroni emettono o assorbono fotoni quando passano da uno stato energetico a un altro
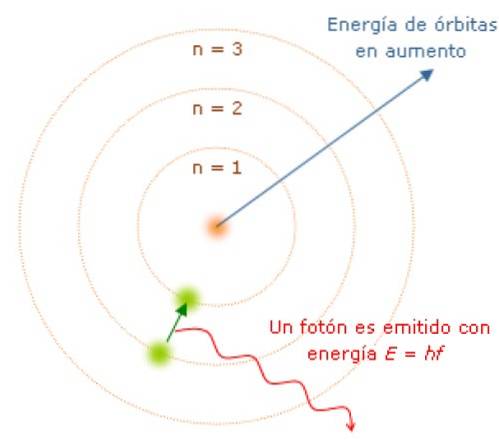
Poiché il momento angolare è quantizzato, lo è anche l'energia E. Si può dimostrare che E è dato da:


L'elettronvolt, o eV, è un'altra unità di energia, ampiamente utilizzata nella fisica atomica. Il segno negativo nell'energia garantisce la stabilità dell'orbita, indicando che sarebbe necessario lavorare per separare l'elettrone da questa posizione..
Mentre l'elettrone è nella sua orbita, non assorbe né emette luce. Ma quando salta da un'orbita di energia superiore a una inferiore, lo fa..
La frequenza f della luce emessa dipende dalla differenza tra i livelli di energia delle orbite:
E = hf = Einiziale - Efinale
Limitazioni
Il modello di Bohr ha alcune limitazioni:
-Viene applicato con successo solo all'atomo di idrogeno. I tentativi di applicarlo ad atomi più complessi non hanno avuto successo.
-Non risponde perché alcune orbite sono stabili e altre no. Il fatto che l'energia nell'atomo fosse quantizzata ha funzionato molto bene, ma il modello non ha fornito una ragione, e questo è stato qualcosa che ha causato disagio agli scienziati..
-Un'altra importante limitazione è che non spiegava le linee aggiuntive emesse dagli atomi in presenza di campi elettromagnetici (effetto Zeeman ed effetto Stark). O perché alcune linee dello spettro erano più intense di altre.
-Il modello di Bohr, inoltre, non considera effetti relativistici, di cui è necessario tener conto, poiché è stato determinato sperimentalmente che gli elettroni sono in grado di raggiungere velocità abbastanza vicine a quella della luce nel vuoto..
-Si presume che sia possibile conoscere con precisione la posizione e la velocità dell'elettrone, ma ciò che viene effettivamente calcolato è la probabilità che l'elettrone occupi una certa posizione.
Nonostante i suoi limiti, il modello ebbe molto successo all'epoca, non solo per integrare nuove scoperte con elementi già noti, ma anche perché sollevava nuove domande, rendendo chiaro che la strada per una spiegazione soddisfacente dell'atomo stava nella meccanica quantistica..
Articoli di interesse
Modello atomico di Schrödinger.
Modello Atomic de Broglie.
Modello atomico di Chadwick.
Modello atomico di Heisenberg.
Il modello atomico di Perrin.
Il modello atomico di Thomson.
Modello atomico di Dalton.
Modello atomico di Dirac Jordan.
Modello atomico di Democrito.
Modello atomico di Leucippo.
Modello atomico di Sommerfeld.
Modello atomico attuale.
Riferimenti
- Bauer, W. 2011. Fisica per l'ingegneria e le scienze. Volume 2. Mc Graw Hill.
- Il modello atomico di Bohr. Recupero da: sgpwe.izt.uam.mx.
- Serway, R. (2008). Fisica per la scienza e l'ingegneria. Volume 2. 7th. Ed. Cengage Learning.
- Thomas Griffith, W. 2007. Fisica concettuale. Mcgraw hill.
- Tomé, C. I limiti del modello di Bohr. Quaderni di cultura scientifica. Estratto da: culturacientifica.com.



Nessun utente ha ancora commentato questo articolo.