
Caratteristiche, struttura, funzioni del lisozima
Il lisozimi sono enzimi idrolitici ampiamente distribuiti in natura capaci di idrolizzare i legami glicosidici del peptidoglicano nella parete dei batteri. Sono presenti nelle piante e negli animali e funzionano come meccanismo di difesa contro le infezioni batteriche.
La scoperta di questi enzimi risale al 1922, quando Alexander Fleming si rese conto che esisteva una proteina che aveva la capacità catalitica di lisare i batteri in alcuni tessuti e secrezioni umane..
Grazie alla sua facile reperibilità e alle sue ridotte dimensioni, il lisozima è stato uno dei primi enzimi ad essere sequenziato e la cui struttura è stata determinata attraverso i raggi X. Attualmente viene utilizzato come sistema modello in chimica, enzimologia, cristallografia e biologia molecolare delle proteine..
Il lisozima è un enzima "batteriolitico" specializzato nell'idrolisi dei legami β-1,4 glicosidici che si formano tra l'acido N-acetilmuramico e l'N-acetilglucosamina presenti nella parete cellulare del peptidoglicano che è particolarmente esposta nei batteri gram-positivi.
Ha varie funzioni, sia digestive che immunologiche, in tutti gli organismi dove viene espressa e utilizzata come risorsa biotecnologica per vari scopi..
Indice articolo
- 1 Caratteristiche
- 2 Tipi di lisozimi negli animali e loro caratteristiche
- 2.1 Lisozimi tipo C
- 2.2 Lisozimi tipo G
- 2.3 Lisozimi di tipo I
- 3 Struttura
- 4 funzioni
- 5 Riferimenti
Caratteristiche
I lisozimi sono espressi dai principali gruppi di organismi viventi del pianeta, ma sono particolarmente abbondanti negli animali ed è da questi che sono stati ulteriormente purificati e studiati..
Negli esseri umani, il lisozima si trova in alte concentrazioni in diversi fluidi e tessuti come il fegato, la cartilagine, la saliva, il muco e le lacrime. È espresso dalle cellule ematopoietiche e si trova anche nei granulociti, monociti e macrofagi, nonché in altre cellule precursori del midollo osseo..
I lisozimi di origine vegetale idrolizzano substrati simili a quelli utilizzati da altri enzimi strettamente correlati noti come chitinasi, per questo motivo possono anche idrolizzare i legami nella chitina, sebbene con minore efficienza.
Tipi di lisozimi negli animali e loro caratteristiche
Almeno tre tipi di lisozimi sono stati descritti nel regno animale:
-Lisozimi di tipo C ("C" da "cconvenzionale "o"cgallina ", Cosa significa pollo in inglese)
-Tipo G lisozimi ("G" da "goose", Che significa oca in inglese) e
-Lisozimi di tipo I ("I" da "ionvertebrati ")
Le tre classi di lisozimi differiscono l'una dall'altra per quanto riguarda le loro sequenze amminoacidiche, le loro caratteristiche biochimiche e le loro proprietà enzimatiche..
Lisozimi di tipo C.
Questi lisozimi sono considerati gli enzimi "modello" di questa famiglia, poiché sono serviti da modello per studi di struttura e funzione. Sono conosciuti come tipo "C" in inglese "pollo“Da quando sono stati isolati per la prima volta dal bianco delle uova di gallina.
In questa classe sono i lisozimi prodotti dalla maggior parte dei vertebrati, in particolare uccelli e mammiferi. Include anche enzimi presenti in alcuni artropodi come Lepidotteri, Ditteri, alcuni aracnidi e crostacei.
Sono piccoli enzimi in quanto hanno un peso molecolare che non supera i 15 kDa. Sono proteine di base con alti punti isoelettrici.
Lisozimi tipo G
Il primo lisozima di questo tipo è stato identificato nell'albume d'oca ed è presente in numerose specie di uccelli come polli, cigni, struzzi, casuari e altri..
In alcuni casi, i lisozimi di tipo G sono più abbondanti dei lisozimi di tipo C negli albumi di alcuni uccelli, mentre in altri è vero il contrario, i lisozimi di tipo C sono più abbondanti.
Questi lisozimi sono presenti anche nei molluschi bivalvi e in alcuni tunicati. Sono leggermente più grandi delle proteine di tipo C, ma il loro peso molecolare di solito non supera i 25 kDa.
Lisozimi di tipo I.
Questi lisozimi sono presenti principalmente negli animali invertebrati. La sua presenza è stata determinata in anellidi, echinodermi, crostacei, insetti, molluschi e nematodi ed è assente nei mammiferi e in altri vertebrati..
Hanno più punti isoelettrici acidi di quelli delle proteine di tipo C e di tipo G..
Struttura
I tre tipi di enzimi animali descritti nella sezione precedente hanno strutture tridimensionali abbastanza simili..
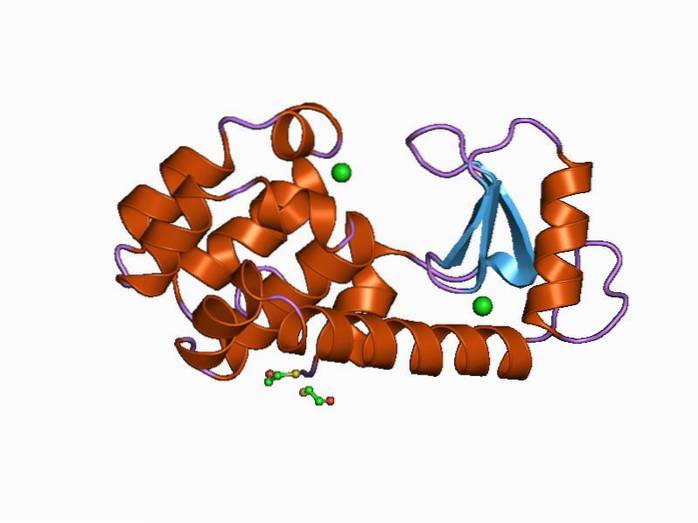
Il lisozima umano è un lisozima di tipo C ed è stato il primo di questi enzimi ad essere studiato e caratterizzato strutturalmente. È una piccola proteina di 130 residui di amminoacidi ed è codificata da un gene situato sul cromosoma 12, che ha 4 esoni e 3 introni..
La sua struttura è divisa in due domini: uno noto come dominio α e un altro simile dominio β. Il dominio α è composto da quattro eliche alfa e il dominio β è costituito da un foglio β antiparallelo e un anello grande.
Il sito catalitico dell'enzima si trova nella fessura che si forma tra entrambi i domini e per il legame con il substrato ha residui di acido glutammico e acido aspartico. Inoltre, ha almeno sei "siti secondari" noti come A, B, C, D, E ed F, in grado di legarsi a sei residui zuccherini consecutivi.
Caratteristiche
Il lisozima non solo ha funzioni fisiologiche nella protezione e lotta contro le infezioni batteriche negli organismi che lo esprimono, ma, come detto, è stato molto utile come enzima modello dal punto di vista chimico, enzimatico e strutturale.
Nell'industria odierna è riconosciuto come un potente battericida e viene utilizzato per la conservazione di alimenti e farmaci.
Grazie alla reazione che questi enzimi catalizzano, possono agire su diverse popolazioni batteriche e alterare la stabilità delle loro pareti, che successivamente si traduce in lisi cellulare..
Insieme ad altri enzimi simili, i lisozimi possono agire sia sui batteri gram-positivi che su quelli gram-negativi, quindi possono essere considerati parti del sistema "immunitario" antibatterico di diverse classi di organismi.
Nei globuli bianchi presenti nel sangue dei mammiferi, questi enzimi hanno importanti funzioni nella degradazione dei microrganismi invasori, rendendoli essenziali per il sistema immunitario dell'uomo e di altri mammiferi.
I lisozimi nelle piante svolgono essenzialmente le stesse funzioni degli animali che li esprimono, poiché sono la prima linea di difesa contro i batteri patogeni..
Riferimenti
- Callewaert, L. e Michels, W. (2010). Lisozimi nel regno animale. J. Biosci., 35(1), 127-160.
- Merlini, G., & Bellotti, V. (2005). Lisozima: una molecola paradigmatica per lo studio della struttura, della funzione e del misfolding delle proteine. Clinica Chimica Acta, 357, 168-172.
- Mir, A. (1977). Lisozima: una breve rassegna. Giornale medico post-laurea, 53, 257-259.
- Sahoo, N. R., Kumar, P., Bhusan, B., Bhattacharya, T. K., Dayal, S. e Sahoo, M. (2012). Lisozima nel bestiame: una guida alla selezione per la malattia. Journal of Animal Science Advances, Due(4), 347-360.
- Wohlkönig, A., Huet, J., Looze, Y. e Wintjens, R. (2010). Relazioni strutturali nella superfamiglia dei lisozimi: prove significative per i motivi distintivi della glicoside idrolasi. PLoS One, 5(11), 1-10.



Nessun utente ha ancora commentato questo articolo.