
Funzioni LDH, determinazione, reazione, valori normali
Il lattato deidrogenasi, L'acido lattico deidrogenasi, lattato deidrogenasi dipendente da NAD o semplicemente LDH, è un enzima appartenente al gruppo delle ossidoreduttasi che si trova praticamente in tutti i tessuti animali e vegetali e in molti microrganismi come batteri, lieviti e archei.
Enzimi di questo tipo sono indicati con il numero EC 1.1.1.27 del Comitato per la nomenclatura degli enzimi e sono responsabili della reazione che converte il lattato in piruvato (per ossidazione) e viceversa (per riduzione), ossidando o riducendo la nicotinamide adenina dinucleotidi (NAD + e NADH) nel processo noto come fermentazione lattica.
A differenza della fermentazione alcolica, che avviene solo in alcuni microrganismi come il lievito e che utilizza piruvato glicolitico per la produzione di etanolo, la fermentazione lattica avviene in molti organismi e tessuti corporei di diversi esseri viventi.
Questo importante enzima per il metabolismo cellulare è stato cristallizzato dal muscolo scheletrico di ratto negli anni '40 e, ad oggi, i più caratterizzati sono il muscolo scheletrico e il tessuto cardiaco dei mammiferi..
Negli animali "superiori" l'enzima utilizza l'isomero L del lattato (L-lattato) per la produzione di piruvato, ma alcuni animali e batteri "inferiori" producono D-lattato dal piruvato ottenuto mediante glicolisi..
La lattato deidrogenasi è solitamente espressa principalmente nei tessuti o nelle cellule in condizioni anaerobiche (con scarso apporto di sangue) che, nell'uomo, ad esempio, possono caratterizzare condizioni patologiche come cancro, fegato o malattie cardiache.
Tuttavia, la conversione del piruvato in lattato è tipica dei muscoli durante l'esercizio e della cornea dell'occhio, che è scarsamente ossigenata.
Indice articolo
- 1 Funzioni
- 2 Caratteristiche e struttura
- 3 Determinazione
- 3.1 Mediante spettrofotometria
- 3.2 Per immunoistochimica
- 3.3 Perché determinare la lattato deidrogenasi?
- 4 Reazione
- 5 Valori normali
- 6 Cosa significa avere un LDH elevato?
- 7 Riferimenti
Caratteristiche
La lattato deidrogenasi svolge molteplici funzioni in numerose vie metaboliche. È il centro del delicato equilibrio tra la via catabolica e quella anabolica dei carboidrati.
Durante la glicolisi aerobica, piruvato (l'ultimo prodotto sul percorso di per sé) può essere utilizzato come substrato per il complesso enzimatico piruvato deidrogenasi, mediante il quale viene decarbossilato, rilasciando molecole di acetil-CoA che vengono utilizzate a valle, metabolicamente parlando, nel ciclo di Krebs.
Nella glicolisi anaerobica, invece, l'ultimo passaggio della glicolisi produce piruvato, ma questo viene utilizzato dalla lattato deidrogenasi per produrre lattato e NAD.+, che ripristina il NAD+ che è stato utilizzato durante la reazione catalizzata dalla gliceraldeide 3-fosfato deidrogenasi.
Poiché durante l'anaerobiosi la principale fonte di produzione di energia sotto forma di ATP è la glicolisi, la lattato deidrogenasi gioca un ruolo fondamentale nella riossidazione dell'NADH prodotto nelle fasi precedenti della via glicolitica, essenziale per il funzionamento di altri enzimi correlati.
La lattato deidrogenasi è anche coinvolta nella glicogenesi che avviene nei tessuti che convertono il lattato in glicogeno e, in alcuni tessuti aerobici come il cuore, il lattato è un combustibile che viene riossidato per produrre energia e ridurre la potenza sotto forma di ATP e NAD+, rispettivamente.
Caratteristiche e struttura
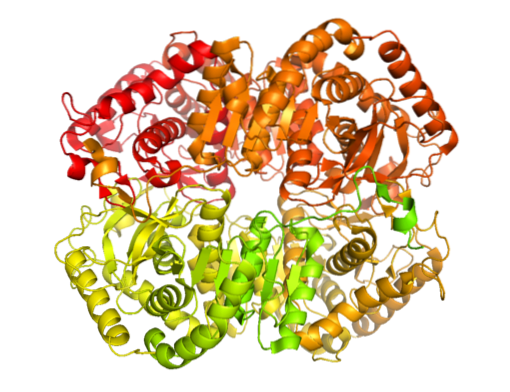
Esistono molteplici forme molecolari di lattato deidrogenasi in natura. Solo negli animali è stato determinato che ci sono cinque attività della lattato deidrogenasi, tutte tetramerica e essenzialmente composte da due tipi di catene polipeptidiche note come subunità H e M (possono essere omo- o eterotetrameriche).
La forma H si trova tipicamente nel tessuto cardiaco, mentre la forma M è stata rilevata nel muscolo scheletrico. Entrambe le catene differiscono l'una dall'altra in termini di abbondanza, composizione amminoacidica, proprietà cinetiche e proprietà strutturali..
Le forme H e M sono il prodotto traslazionale di geni differenti, possibilmente localizzati su cromosomi differenti, e che sono anche sotto il controllo o la regolazione di geni differenti. La forma H è predominante nei tessuti con metabolismo aerobico e la forma M nei tessuti anaerobici..
Un altro tipo di nomenclatura utilizza le lettere A, B e C per i diversi tipi di enzimi sia nei mammiferi che negli uccelli. Pertanto, la lattato deidrogenasi muscolare è nota come A4, il cuore come B4 e un terzo si chiama C4, che è specifico per i testicoli.
L'espressione di questi isoenzimi è regolata sia dallo sviluppo dipendente che dal tessuto..
L'enzima è stato isolato da diverse fonti animali ed è stato determinato che la sua struttura tetramerica ha un peso molecolare medio di circa 140 kDa e che il sito di legame per NADH o in NAD+ è costituito da un foglio piegato a β composto da sei catene e 4 eliche alfa.
Determinazione
Tramite spettrofotometria
L'attività della lattato deidrogenasi di origine animale viene determinata spettrofotometricamente in vitro mediante misurazioni del cambiamento di colore dovuto al processo redox che ha luogo durante la reazione di conversione da piruvato a lattato.
Le misurazioni vengono effettuate a 340 nm con uno spettrofotometro e viene determinata la velocità di diminuzione della densità ottica dovuta all'ossidazione o "scomparsa" del NADH, che viene convertito in NAD.+.
Cioè, la reazione determinata è la seguente:
Piruvato + NADH + H+ → Lattato + NAD+
La misura enzimatica deve essere eseguita in condizioni ottimali di pH e concentrazione di substrati per l'enzima, in modo che non ci sia il rischio di sottovalutare la quantità presente nei campioni a causa di un deficit di substrati o condizioni estreme di acidità o basicità.
Per immunoistochimica
Un altro metodo, forse un po 'più moderno, per determinare la presenza della lattato deidrogenasi ha a che fare con l'uso di strumenti immunologici, cioè con l'uso di anticorpi..
Questi metodi sfruttano l'affinità tra il legame di un antigene con un anticorpo specificamente generato contro di esso e sono molto utili per la determinazione rapida della presenza o dell'assenza di enzimi come LDH in un particolare tessuto..
A seconda dello scopo, gli anticorpi utilizzati devono essere specifici per la rilevazione di uno qualsiasi degli isoenzimi o per qualsiasi proteina con attività lattato deidrogenasi..
Perché determinare la lattato deidrogenasi?
La determinazione di questo enzima viene eseguita per diversi scopi, ma principalmente per la diagnosi clinica di alcune condizioni, tra cui l'infarto del miocardio e il cancro..
A livello cellulare, il rilascio di lattato deidrogenasi è stato considerato uno dei parametri per determinare l'insorgenza di processi necrotici o apoptotici, poiché la membrana plasmatica diventa permeabile.
I prodotti della reazione che catalizza possono anche essere determinati in un tessuto al fine di determinare se predomina un metabolismo anaerobico per una ragione particolare..
Reazione
Come accennato inizialmente, l'enzima lattato deidrogenasi, il cui nome sistematico è (S) -lattato: NAD+ deidrogenasi, catalizza la conversione del lattato in piruvato nella forma NAD+ dipendente, o viceversa, che avviene grazie al trasferimento di uno ione idruro (H.-) da piruvato a lattato o da NADH a piruvato ossidato.

Il NAD+ Ha un'unità di ADP e un altro gruppo nucleotidico derivato dall'acido nicotinico, chiamato anche niacina o vitamina B3, e questo coenzima partecipa a molteplici reazioni di grande importanza biologica.
È importante notare che l'equilibrio in questa reazione è spostato verso il lato lattato ed è stato dimostrato che l'enzima è anche in grado di ossidare altri acidi (S) -2-idrossimonocarbossilici e impiegano, sebbene in modo meno efficiente, NADP+ come substrato.
A seconda della regione corporea considerata e, allo stesso tempo, delle sue caratteristiche metaboliche in relazione alla presenza o assenza di ossigeno, i tessuti producono quantità differenti di lattato, prodotto della reazione catalizzata da LDH..
Considerando, ad esempio, un globulo rosso (eritrocita) privo di mitocondri in grado di metabolizzare a CO il piruvato prodotto durante la glicolisiDue e acqua, quindi si potrebbe dire che queste sono le principali cellule produttrici di lattato nel corpo umano, poiché tutto il piruvato viene convertito in lattato dall'azione della lattato deidrogenasi.
D'altra parte, se si considerano le cellule del fegato e le cellule del muscolo scheletrico, sono responsabili della produzione di una quantità minima di lattato, poiché viene rapidamente metabolizzato..
Valori normali
La concentrazione di lattato deidrogenasi nel siero del sangue è il prodotto dell'espressione di diversi isoenzimi nel fegato, nel cuore, nel muscolo scheletrico, negli eritrociti e nei tumori, tra gli altri..
Nel siero sanguigno, i normali intervalli di attività della lattato deidrogenasi sono compresi tra 260 e 850 U / ml (unità per millilitro), con un valore medio di 470 ± 130 U / ml. Nel frattempo, gli emolisati del sangue hanno un'attività LDH che varia tra 16.000 e 67.000 U / ml, che equivale a una media di 34.000 ± 12.000 U / ml..
Cosa significa avere un LDH elevato?
La quantificazione della concentrazione di lattato deidrogenasi nel siero del sangue ha un valore importante nella diagnosi di alcune malattie cardiache, del fegato, del sangue e persino dei tumori.
Alti livelli di attività LDH sono stati riscontrati in pazienti con infarto miocardico (sia sperimentale che clinico), così come in pazienti oncologici, in particolare nelle donne con carcinoma endometriale, ovarico, mammario e uterino..
A seconda del particolare isoenzima trovato in "eccesso" o alta concentrazione, la quantificazione degli isoenzimi della lattato deidrogenasi viene utilizzata da molti medici curanti per la determinazione del danno tissutale (grave o cronico)..
Riferimenti
- Bergmeyer, H., Bernt, E. e Hess, B. (1961). Lattica deidrogenasi. Metodi di analisi enzimatica. Verlag Chemie, GmbH.
- Chung, F., Tsujubo, H., Bhattacharyya, U., Sharief, F. e Li, S. (1985). Organizzazione genomica del gene della lattato deidrogenasi-A umana. Giornale biochimico, 231, 537-541.
- De Becker, D. (2003). Acidosi lattica. Terapia intensiva MEd, 29, 699-702.
- Everse, J. e Kaplan, N. (1973). Lattato deidrogenasi: struttura e funzione. Nel Progressi in enzimologia e aree correlate di biologia molecolare (pagg. 61-133).
- Fox, S. I. (2006). Fisiologia umana (9 ° ed.). New York, USA: McGraw-Hill Press.
- Huijgen, H., Sanders, G. T. B., Koster, R. W., Vreeken, J., & Bossuyt, P. M. M. (1997). Il valore clinico della lattato deidrogenasi nel siero: una revisione quantitativa. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Comitato per la nomenclatura dell'Unione internazionale di biochimica e biologia molecolare (NC-IUBMB). (2019). Estratto da www.qmul.ac.uk/sbcs/iubmb/enzyme/index.html
- Rawn, J. D. (1998). Biochimica. Burlington, Massachusetts: Neil Patterson Publishers.
- Usategui-Gomez, M., Wicks, R. W. e Warshaw, M. (1979). Determinazione immunochimica dell'isoenzima cardiaco della lattato deidrogenasi (LDH1) nel siero umano. Clin Chem, 25(5), 729-734.
- Wróblewski, F. e Ladue, J. S. (1955). Attività lattica degidrogenasi nel sangue. Biologia e medicina sperimentale, 90, 210-215.



Nessun utente ha ancora commentato questo articolo.