
Formula, proprietà e usi dell'acido cloridrico (HClO2)

Il acido cloridrico è un composto inorganico con la formula HClODue. Detto acido è uno degli acidi ossiacidi del cloro dove si trova nello stato di ossidazione 3+. Sebbene l'acido sia difficile da ottenere nella sua sostanza pura, la base coniugata derivata da questi acidi, lo ione clorito, è stabile..
Un esempio di un sale di questo anione è il noto clorito di sodio. Questo e i relativi sali vengono talvolta utilizzati nella produzione di biossido di cloro..
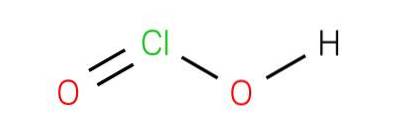
L'acido cloridrico è un acido debole. La sostanza pura è instabile, sproporzionata rispetto all'acido ipocloroso (Cl +1 stato di ossidazione) e all'acido clorico (Cl +5 stato di ossidazione):
2HClODue → HClO + HClO3
L'acido cloridrico si ottiene, insieme all'acido clorico, nella decomposizione della soluzione acquosa di biossido di cloro.
La soluzione di acido cloridrico è stata ottenuta per la prima volta riducendo l'acido clorico con acido tartarico (A. J. Downs, 1973), tuttavia, il metodo principale per ottenere questo acido è trattare una sospensione di cloruro di bario con acido solforico:
Ba (ClODue)Due + HDueSW4 → BaSO4 + 2HClODue
L'acido cloridrico è un potente agente ossidante, sebbene la sua tendenza alla dismutazione o alla sproporzione contrasti il suo potenziale ossidante..
Il cloro è l'unico alogeno che forma un acido isolabile di formula HXODue. Non sono stati isolati né l'acido bromo né l'acido iodico. Sono noti alcuni sali dell'acido bromo, i bromiti, ma, eccetto come intermedi nelle reazioni, non ci sono sali ioditi..
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Reattività e pericoli
- 3 usi
- 4 Riferimenti
Proprietà fisiche e chimiche
L'acido cloridrico, quando isolato, è un liquido incolore senza un aroma caratteristico (National Center for Biotechnology Information, 2017).
Il composto ha un peso molecolare di 68,456 g / mol. Ha un punto di ebollizione (calcolato) di 502,07 ° C e una solubilità in acqua (calcolata) di 1 × 106 mg / l (Royal Society of Chemistry, 2015).
HClODue è instabile a causa della reazione di dismutazione (o sproporzione) per produrre acido clorico e ipocloroso (C. C. Hong, 1968) simile a quella dell'analogo bromo e iodio:
2HClODue → HClO + HClO3
L'acido cloridrico è considerato un acido debole sebbene la sua costante di dissociazione sia dell'ordine di 1 x 10-Due il che non lo rende debole come altri acidi con un pKa di 1,96.
Reattività e rischi
L'acido cloridrico è un composto instabile e un forte agente ossidante incompatibile con agenti riducenti e alcali..
L'acido cloridrico irrita in caso di contatto con la pelle e gli occhi ed è pericoloso in caso di ingestione e inalazione.
In caso di contatto con gli occhi, controllare se si indossano lenti a contatto e rimuoverle immediatamente. Gli occhi devono essere lavati con acqua corrente per almeno 15 minuti, tenendo le palpebre aperte. È possibile utilizzare acqua fredda. Unguento per gli occhi non deve essere utilizzato.
Se la sostanza chimica viene a contatto con gli indumenti, rimuoverla il più rapidamente possibile, proteggendo le mani e il corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula sulla pelle esposta della vittima, come le mani, la pelle contaminata viene lavata delicatamente e accuratamente con acqua corrente e sapone non abrasivo..
È possibile utilizzare acqua fredda. Se l'irritazione persiste, consultare il medico. Lavare gli indumenti contaminati prima di riutilizzarli.
Se il contatto con la pelle è grave, deve essere lavato con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica..
In caso di inalazione, consentire alla vittima di riposare in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il prima possibile. Allenta gli indumenti stretti come il colletto della camicia, la cintura o la cravatta.
Se la vittima ha difficoltà a respirare, deve essere somministrato ossigeno. Se la vittima non respira, viene eseguita la rianimazione bocca a bocca. Tenere sempre presente che può essere pericoloso per la persona che fornisce assistenza eseguire la rianimazione bocca a bocca quando il materiale inalato è tossico, infettivo o corrosivo..
In caso di ingestione, non provocare il vomito. Allenta indumenti stretti come colletti di camicie, cinture o cravatte. Se la vittima non respira, eseguire la rianimazione bocca a bocca. In tutti i casi, consultare immediatamente un medico..
Applicazioni
Sono stati condotti studi in cui vengono utilizzate soluzioni metastabili di acido cloridrico / ossido di cloro come collutorio per la riduzione della placca (Goultschin J, 1989).
Lo studio è stato condotto su un gruppo di 18 volontari di età compresa tra 20 e 27 anni. È stato testato il suo effetto sullo sviluppo della placca e sulla conta batterica salivare, ottenendo una riduzione fino al 34,5% dei punteggi della placca dentale rispetto a un gruppo placebo.
L'acido cloridrico è coinvolto nella preparazione del clorito acido di sodio che ha proprietà antimicrobiche ed è destinato ad essere utilizzato principalmente come soluzione spray o per immersione per pollame, carne, verdura, frutta e frutti di mare. Utilizzato anche nell'acqua di raffreddamento del pollame.
Il clorito acido di sodio viene prodotto aggiungendo un acido alimentare (ad esempio, acido citrico, acido fosforico, acido cloridrico, acido malico o acido solfato di sodio) a una soluzione acquosa di clorito di sodio (NaClODue).
La combinazione dell'acido con la soluzione di clorito di sodio porta alla conversione del clorito in acido cloridrico metastabile (HClODue).
NaClODue + H+ ⇌ HClODue + N / A+
Questa soluzione può successivamente formare una miscela con clorito (ClODue-), biossido di cloro (ClODue) e cloruro (Cl¯). La reazione genera una soluzione ossidativa con specie ossiclorurate con proprietà antimicrobiche.
Il clorito acido di sodio è progettato per essere utilizzato come parte di un approccio integrato progettato per controllare la carica microbica negli alimenti.
La soluzione di clorito acido di sodio agisce per ridurre il numero di agenti patogeni (ad esempio, Escherichia coli, E. coli O157: H7, Salmonella spp., Campylobacter spp., And Listeria monocytogenes) (Rao, 2006).
Riferimenti
- J. Downs, C. J. (1973). La chimica del cloro, del bromo, dello iodio e dell'astato: Pergamon…, Volume 7. New York: stampa di Pergamon.
- C. Hong, W. H. (1968). Cinetica della sproporzione dell'acido cloridrico. Canadian Journal of Chemistry 46 (12): , 2053-2060. nrcresearchpress.com.
- EMBL-EBI. (2014, 28 luglio). acido cloridrico. Recupero da ChEBI: ebi.ac.uk.
- Goultschin J, G. J. (1989). Uso di una formulazione metastabilizzata di acido cloridrico / biossido di cloro come collutorio per la riduzione della placca. Isr J Dent Sci.2 (3), 142-147. ncbi.nlm.nih.gov.
- National Center for Biotechnology Information ... (2017, 30 aprile). CID database composto di PubChem = 24453. Estratto da PubChem.
- Rao, M. V. (2006, dicembre). CLORITO DI SODIO ACIDIFICATO (ASC) Valutazione chimica e tecnica. Recuperato da fao.org.
- Royal Society of Chemistry. (2015). Acido cloridrico. Recupero da chemspider.com.



Nessun utente ha ancora commentato questo articolo.