
Biografia e contributi di Joseph Thomson alla scienza e alla chimica
Joseph John Thomson Fu un chimico eccezionale per vari contributi, come la scoperta dell'elettrone, il suo modello atomico, la scoperta degli isotopi o l'esperimento dei raggi catodici.
Nacque a Cheetam Hill, un distretto di Manchester, in Inghilterra, il 18 dicembre 1856. Conosciuto anche come "J.J." Thomson, ha studiato ingegneria all'Owens College, ora parte dell'Università di Manchester, e successivamente matematica a Cambridge.

Nel 1890, J. J. Thomson sposò Rose Elizabeth Paget, figlia del medico Sir Edward George Paget, dal quale ebbe due figli: una ragazza, di nome Joan Paget Thomson, e un ragazzo, George Paget Thomson..
Quest'ultimo sarebbe diventato un famoso scienziato, ottenendo nel 1937 il Premio Nobel per la Fisica per il suo lavoro con gli elettroni..
Fin dalla giovane età, Thomson ha concentrato i suoi studi sulla struttura degli atomi, scoprendo così l'esistenza di elettroni e isotopi, tra molti altri contributi..
Nel 1906, Thomson ricevette il Premio Nobel per la Fisica, "in riconoscimento del grande merito della sua ricerca teorica e sperimentale sulla conduzione dell'elettricità attraverso i gas", tra molti altri premi per il suo lavoro. (1)
Nel 1908 fu nominato cavaliere dalla corona britannica e prestò servizio come professore onorario di fisica a Cambridge e al Royal Institute di Londra..
Morì il 30 agosto 1940, all'età di 83 anni, nella città di Cambridge, nel Regno Unito. Il fisico fu sepolto nell'Abbazia di Westminster, vicino alla tomba di Sir Isaac Newton. (Due)
Indice articolo
- 1 Principali contributi di Thomson alla scienza
- 1.1 Scoperta dell'elettrone
- 1.2 Modello atomico di Thomson
- 1.3 Separazione degli atomi
- 1.4 Scoperta degli isotopi
- 1.5 Esperimenti sui raggi catodici
- 1.6 Spettrometro di massa
- 2 L'eredità di Thomson
- 3 opere eccezionali
- 4 Riferimenti
I principali contributi di Thomson alla scienza
Scoperta dell'elettrone
Nel 1897, J.J. Thomson scoprì una nuova particella più leggera dell'idrogeno, chiamata "elettrone".
L'idrogeno era considerato un'unità di misura del peso atomico. Fino a quel momento, l'atomo era la più piccola divisione della materia.
In questo senso, Thomson fu il primo a scoprire particelle subatomiche corpuscolari caricate negativamente.
Il modello atomico di Thomson
Il modello atomico di Thomson era la struttura che il fisico inglese attribuiva agli atomi. Per lo scienziato, gli atomi erano una sfera di carica positiva.
Lì gli elettroni di carica negativa erano incorporati, distribuiti uniformemente su quella nuvola di carica positiva, cioè neutralizza la carica positiva della massa dell'atomo..
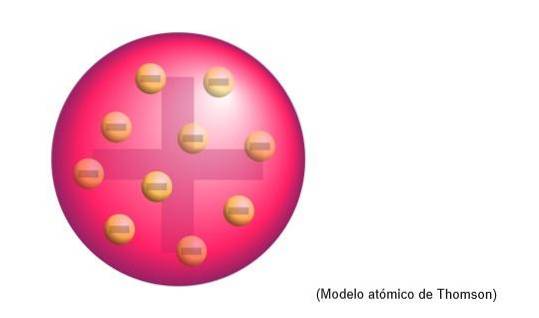
Questo nuovo modello sostituisce quello sviluppato da Dalton e sarà successivamente confutato da Rutherford, un discepolo di Thomson ai Cavendish Laboratories, Cambridge..
Separazione degli atomi
Thomson usava raggi positivi o anodici per separare atomi di masse diverse. Questo metodo gli ha permesso di calcolare l'elettricità trasportata da ogni atomo e il numero di molecole per centimetro cubo..
Riuscendo a dividere atomi di massa e carica differenti, il fisico ha scoperto l'esistenza degli isotopi. Anche in questo modo, con il suo studio dei raggi positivi, ha prodotto un grande progresso verso la spettrometria di massa..
Scoperta degli isotopi
J.J. Thomson ha scoperto che gli ioni neon avevano masse diverse, cioè pesi atomici diversi. Ecco come Thomson ha dimostrato che il neon ha due sottotipi di isotopi, neon-20 e neon-22..
Gli isotopi, studiati fino ad oggi, sono atomi dello stesso elemento ma i loro nuclei hanno un numero di massa diverso, poiché sono composti da diverse quantità di neutroni nel loro centro..
Esperimenti sui raggi catodici
I raggi catodici sono correnti di elettroni nei tubi a vuoto, cioè tubi di vetro con due elettrodi, uno positivo e uno negativo..
Quando l'elettrodo negativo, o anche chiamato catodo, viene riscaldato, emette radiazioni dirette verso l'elettrodo positivo, o anodo, in linea retta se in quel percorso non è presente alcun campo magnetico.
Se le pareti di vetro del tubo sono ricoperte di materiale fluorescente, il colpo dei catodi contro quello strato produce la proiezione della luce.
Thomson ha studiato il comportamento dei raggi catodici ed è giunto alla conclusione che i raggi viaggiavano in linea retta.
Inoltre questi raggi potrebbero essere deviati dal loro percorso dalla presenza di un magnete, cioè un campo magnetico. Inoltre, i raggi potevano muovere le lame con la forza della massa degli elettroni circolanti, dimostrando così che gli elettroni avevano massa..
J.J. Thomson ha sperimentato la variazione del gas all'interno del tubo a raggi catodici, ma non ha modificato il comportamento degli elettroni. Inoltre, i raggi catodici riscaldavano gli oggetti che si frapponevano tra gli elettrodi..
In conclusione, Thomson aveva dimostrato che i raggi catodici avevano effetti luminosi, meccanici, chimici e termici..
I tubi a raggi catodici e le loro proprietà luminose furono trascendentali per la successiva invenzione della televisione a tubo (CTR) e delle videocamere..
Spettrometro di massa
J.J. Thomson ha creato un primo approccio a Spettrometro di massa. Questo strumento ha permesso allo scienziato di studiare la relazione massa / carica dei tubi a raggi catodici e misurare quanto deviano a causa dell'influenza di un campo magnetico e la quantità di energia che trasportano..
Con questa ricerca è giunto alla conclusione che i raggi catodici erano composti da corpuscoli caricati negativamente, che sono all'interno di atomi, postulando così la divisibilità dell'atomo e dando origine alla figura dell'elettrone..
Allo stesso modo, i progressi nella spettrometria di massa sono continuati fino ad oggi, evolvendosi in metodi diversi per separare gli elettroni dagli atomi..
Inoltre, Thomson è stato il primo a suggerirlo la prima guida d'onda nel 1893. Questo esperimento consisteva nella propagazione di onde elettromagnetiche all'interno di una cavità cilindrica controllata, che fu eseguita per la prima volta nel 1897 da Lord Rayleigh, un altro premio Nobel per la fisica..
Le guide d'onda sarebbero ampiamente utilizzate in futuro, anche oggi con la trasmissione dei dati e le fibre ottiche.
L'eredità di Thomson
Il Thomson (Th) è stato stabilito come unità di misura della carica di massa nella spettrometria di massa, proposta dai chimici Cooks e Rockwood, in onore di Thomson..
Questa tecnica permette di determinare la distribuzione delle molecole di una sostanza in base alla loro massa e, da questa, di riconoscere quali sono presenti in un campione di materia..
Formula di Thomson (Th):
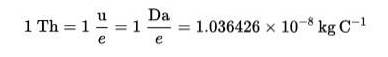
Opere eccezionali
- La dispersione dell'elettricità attraverso i gas, la conduzione dell'elettricità attraverso i gas (1900).
- The Corpuscular Theory of Matter, The Electron in Chemistry and Recollections and Reflections (1907).
- Oltre l'elettrone (1928).
Riferimenti
- Nobel Media AB (2014). J. Thomson - Biografica. Nobelprize.org. nobelprize.org.
- Thomson, Joseph J., Conduzione di elettricità attraverso i gas. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Il fascino discreto delle particelle elementari.
- Christen, Hans Rudolf, Fondamenti di chimica generale e inorganica, volume 1. Barcelona, Spagna. Ediciones Reverté S.A., 1986.
- Arzani, Aurora Cortina, Chimica elementare generale. Messico, editoriale Porrúa, 1967.
- R. G. Cooks, A. L. Rockwood. Rapid Commun. Spettro di massa. 5, 93 (1991).


Nessun utente ha ancora commentato questo articolo.