
Caratteristiche, struttura ed esempi isopropilici
Il isopropile o isopropile è un gruppo o sostituente alchilico, uno dei più comuni e semplici trovati in chimica organica. È uno degli isomeri strutturali del propile, CH3CHDueCHDue-, gruppo derivato dal propano, CH3CHDueCH3. Il suo scheletro potrebbe essere scritto come (CH3)DueCH-, dimostrando che ha anche tre atomi di carbonio.
L'isopropile quando si trova in grandi molecole è semplificato con il simbolo iPr; sebbene in piccoli composti non sia necessario ed è molto facile identificarlo. Da esso si possono ottenere una varietà di composti organici che, sebbene di aspetto semplice, sono versatili per diverse applicazioni; tra questi, l'alcol isopropilico, (CH3)DueCHOH.

Sopra è mostrato lo scheletro di carbonio del gruppo isopropilico. Si noti che al centro abbiamo il carbonio “secondario”, che è legato a due gruppi metilici, CH3, ad un idrogeno e ad un segmento sconosciuto rappresentato da sinuosità; Questi possono essere un eteroatomo, un gruppo funzionale, una catena alifatica (R), un anello aromatico (Ar), ecc..
Se osservato, il gruppo isopropile assomiglia a una Y, caratteristica essenziale per riconoscerlo a prima vista quando si considera una qualsiasi struttura molecolare. Più piccolo è l'isopropile rispetto alla molecola di cui fa parte, si dice che agisca semplicemente da sostituente, cosa che si trova in molti composti.
Indice articolo
- 1 Caratteristiche
- 2 Struttura
- 3 Esempi di composti con isopropile
- 3.1 Alcool isopropilico
- 3.2 alogenuri isopropilici
- 3.3 Isopropilammina
- 3.4 Lorcainide
- 3.5 Altri
- 4 Riferimenti
Caratteristiche
Coinvolgendo un po 'di più la natura chimica del gruppo isopropile, possiamo aggiungere che oltre ad essere alchile (e alifatico), cioè composto solo da atomi di carbonio e idrogeno, è non polare. Questo perché tutti i suoi legami, C-H e C-C, sono di bassa polarità, quindi non ci sono regioni ricche o povere di elettroni (dipoli).
L'apolarità dell'isopropile non significa che sia povero di elettroni; al contrario, come sostituente li dà agli atomi più elettronegativi. Ecco perché ovunque vediamo la Y in una molecola, sapremo che ha dato densità elettronica all'ambiente circostante; sebbene il risultato finale sia una zona priva di dipolo.
Si dice anche che l'isopropile sia alifatico perché manca di aromaticità, che si trova negli anelli con doppi legami coniugati (tipo benzene).
Per quanto riguarda il nome, l'origine del prefisso iso verrà spiegata nella sezione seguente. Tuttavia, il suo nome IUPAC diventa 1-metiletile, poiché nel secondo carbonio della catena etilica, -CHDueCH3, sostituiamo un gruppo metilico con una H, -CH (CH3) CH3, che può anche essere scritto come -CH (CH3)Due.
Struttura
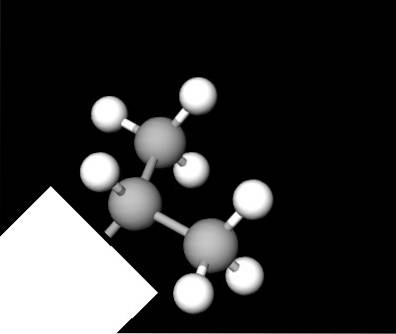
La struttura del gruppo isopropile è mostrata sopra, rappresentata da un modello di sfere e barre. In esso apprezziamo ancora una volta la Y; ma non è piatto come si potrebbe pensare all'inizio. La scatola bianca si comporta come le sinuosità nella prima immagine, nascondendo l'altro segmento della molecola indipendentemente dal composto..
Tutti gli atomi di carbonio hanno ibridazione chimica sp3, quindi non è possibile per loro risiedere sullo stesso aereo. I legami C-C hanno un angolo approssimativo di 109,5º, che deforma le estremità della Y leggermente al di sotto o al di sopra del suo ipotetico piano..
Questa visione della sua struttura è molto utile perché rende ancora più facile il riconoscimento quando si osservano altri modelli molecolari..
Se un piano dello specchio fosse disegnato nel mezzo del carbonio CH, si vedrebbe che i gruppi metilici sono "riflessi" su entrambi i lati dello specchio. Pertanto, questo piano divide il gruppo -CH (CH3)Due in due metà identiche; un fatto che non accadrebbe con il propile, poiché è una catena lineare. Da lì deriva il prefisso iso-, da "uguale", utilizzato per questo sostituente alchilico.
Esempi di composti con isopropile
Alcool isopropilico
Forse l'alcol isopropilico è il composto derivato isopropilico più notevole, poiché è anche l'alcol secondario più semplice, ampiamente commercializzato in bottiglie di plastica all'interno delle farmacie come soluzione antisettica. La sua struttura è:
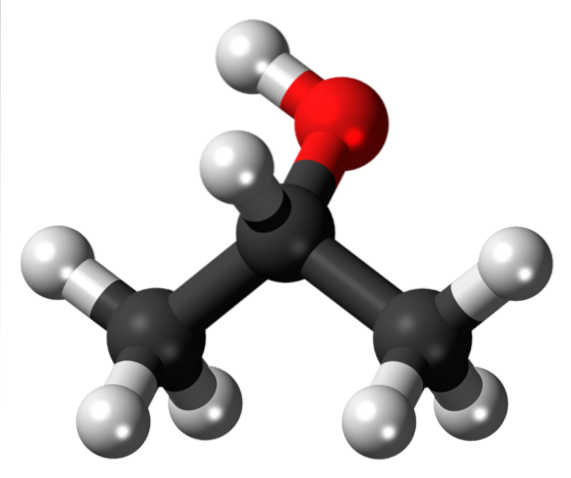
Notare che al centro, sotto il gruppo OH (rosso) troviamo di nuovo la Y, che dà la falsa apparenza di essere piatto. Questo alcol si ottiene semplicemente cambiando le sinuosità o il box bianco già mostrato dal gruppo OH. Lo stesso vale per altri gruppi o eteroatomi.
Alogenuri isopropilici
Supponiamo ora che non sia l'OH ma un atomo di alogeno X (F, Cl, Br e I). In tal caso, otteniamo gli alogenuri isopropilici, XCH (CH3)Due. Questi composti organici sono caratterizzati dall'essere liquidi altamente volatili, possibilmente usati come fonti di isopropile nelle reazioni di alchilazione (la loro aggiunta ad altre molecole)..
Tra questi alogenuri abbiamo quindi:
-Fluoruro di isopropile, FCH (CH3)Due
-Cloruro di isopropile, ClCH (CH3)Due
-Bromuro di isopropile, BrCH (CH3)Due
-Ioduro di isopropile, ICH (CH3)Due
Le sue strutture sono identiche a quella dell'alcol isopropilico, cambiando solo la dimensione degli atomi attaccati al carbonio centrale o secondario..
Isopropilammina
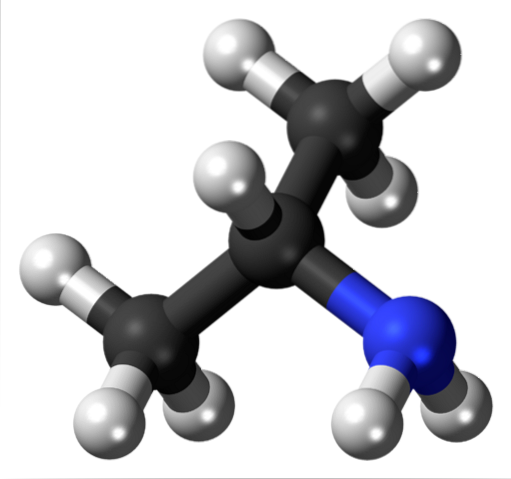
Ora non si tratta dell'OH o degli alogeni, ma del gruppo amminico funzionale, NHDue (immagine in alto). Come con l'alcol isopropilico, l'isopropilammina è un'ammina secondaria e un punto di partenza per la sintesi di vari insetticidi. Non è commercializzato allo stesso modo, poiché è puzzolente e infiammabile, essendo quindi un composto pericoloso.
Lorcainida

Abbiamo lasciato i derivati isopropilici e abbiamo iniziato a vederlo come un semplice sostituente. La lorcainide (sopra) è un farmaco controverso usato per normalizzare i ritmi cardiaci. Se si osserva la molecola, sarà facile in pochi secondi vedere la Y alla sua sinistra, che rappresenta l'isopropile.
In alcune formule, il simbolo iPr viene utilizzato al posto di Y; ma di solito viene applicato per molecole ancora più voluminose e complicate.
Altri
Infine, verranno citati altri esempi con le rispettive formule o modelli strutturali come esercizio per individuare l'isopropile:

La Y dell'isopropile si trova ora sul lato destro secondo questa rappresentazione della mazapertina, un farmaco antipsicotico.
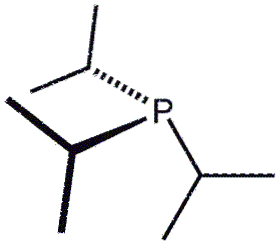
Questa volta abbiamo tre gruppi isopropilici, P (CH (CH3)Due)3, rappresentato da tre Y. La formula potrebbe anche essere scritta come PiPr3 o P (iPr)3.
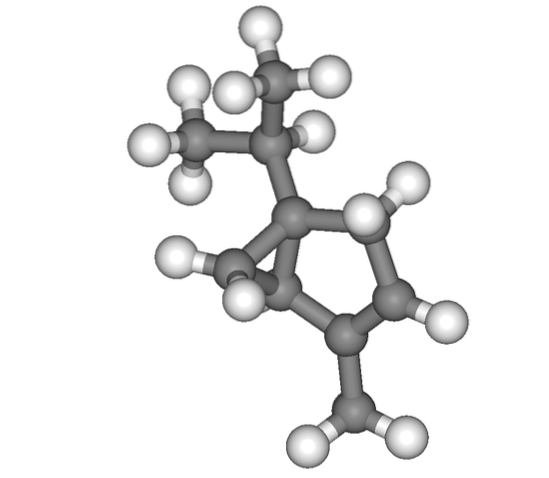
E infine abbiamo il monoterpene thuyen, la cui struttura a prima vista può creare confusione su dove si trova l'isopropile. Ma dopo averlo guardato con calma, noterai che questo è in alto.
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Steven A. Hardinger. (2017). Glossario illustrato di chimica organica: isopropile. Estratto da: chem.ucla.edu
- Elsevier B.V. (2019). Gruppo isopropilico. ScienceDirect. Estratto da: sciencedirect.com
- Wikipedia. (2019). Categoria: Composti isopropilici. Estratto da: en.wikipedia.org



Nessun utente ha ancora commentato questo articolo.