
Isomeria
Cos'è l'isomeria?
L'isomerismo è un fenomeno chimico caratterizzato dal fatto che molecole con lo stesso numero di atomi hanno proprietà chimiche o fisiche differenti. Pertanto, si verifica negli isomeri, che a loro volta sono molecole le cui formule chimiche sono le stesse, ma le loro strutture o disposizioni spaziali differiscono sostanzialmente l'una dall'altra..
Abbiamo l'isomeria costituzionale o strutturale e l'isomeria spaziale, che concentra molta attenzione sulla stereochimica. Il diagramma di flusso nell'immagine sotto mostra che gli isomeri sono principalmente suddivisi nei due tipi di isomeria appena menzionati: costituzionale e stereoisomeri..
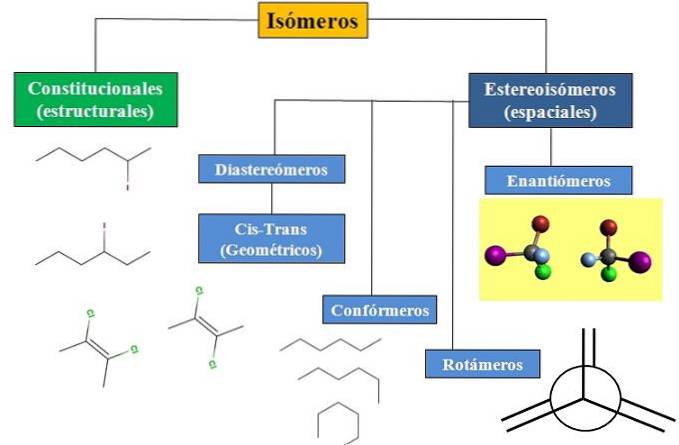
Tutti gli isomeri, per un certo composto, hanno la stessa formula chimica. Ma le strutture che questi atomi possono costruire e le loro proporzioni sono uniche per ogni molecola o isomero. Inoltre, sebbene la struttura stessa sia la stessa, gli atomi o gruppi possono occupare diverse posizioni spaziali..
Il diagramma di flusso mostra alcuni esempi di isomeri che verranno discussi nelle sezioni successive..
Tipi di isomeri
Costituzionale
Gli isomeri costituzionali o strutturali sono quelli che differiscono nell'ordine della spina dorsale molecolare. Cioè, i loro atomi non sono collegati allo stesso modo, quindi la struttura oi gruppi funzionali in questione possono diventare molto diversi..
Ad esempio, per la stessa formula chimica C7H10Oppure ci possono essere più molecole che soddisfano quel numero di atomi; avranno tutti un singolo atomo di ossigeno, ma la disposizione strutturale degli altri atomi sarà unica per ogni isomero.
E da qui le proprietà chimiche e fisiche di tutti gli isomeri costituzionali per la formula C7H10Oppure saranno anche molto diversi l'uno dall'altro.
D'altra parte, gli isomeri costituzionali possono essere molto semplici, variando solo nella posizione relativa di un singolo atomo o gruppo. Nella prossima sezione vedrai un esempio di questo e di quanto detto sopra.
Stereoisomeri
Gli stereoisomeri sono quelli che hanno lo stesso ordinamento strutturale, ma differiscono nelle posizioni e negli orientamenti spaziali dei loro atomi o gruppi..
Perché la loro esistenza sia possibile, le molecole devono contenere centri stereogenici, i più famosi in chimica organica sono gli atomi di carbonio asimmetrici o chirali; cioè, con quattro diversi sostituenti.
Oltre ai carboni asimmetrici, la molecola considerata deve essere priva di elementi di simmetria. Altrimenti, è impossibile che l'ordinamento spaziale diventi stereoisomerismo..
Enantiomeri
Gli enantiomeri sono stereoisomeri costituiti da immagini speculari non sovrapposte. Ad esempio, le mani destra e sinistra non si sovrappongono, così come le scarpe o i guanti. La prossima sezione affronterà il classico esempio di enantiomerismo: bromochloro domethane: CBrClI.
Diastereomers
I diastereomeri, d'altra parte, sono anche stereoisomeri ma non sono immagini speculari. Vale a dire che posti uno di fronte all'altro non sono il riflesso di se stessi. Tra i diastereomeri più noti abbiamo l'isomeria cis-trans, detta anche isomeria geometrica, soprattutto se applicata ad alcheni.
Conformatori
I conformeri, sebbene all'interno dello spettro della stereoisomeria, non sono in realtà isomeri. Sono configurazioni spaziali che una molecola, in un certo momento o stato energetico, acquisisce attraverso le rotazioni di molti dei suoi legami. Vedremo nella prossima sezione l'esempio dei conformeri del n-esano.
Rotameri
Infine abbiamo i rotameri, che assomigliano a conformeri nel senso che dipendono dalla rotazione dei legami covalenti..
Tuttavia, un singolo legame tra due atomi di carbonio viene preso come riferimento e vengono confrontate le posizioni relative, eclissate o alternate, dei sostituenti per entrambi gli atomi di carbonio. Più avanti vedremo l'esempio dei rotameri del propilene.
Esempi di isomeri
Esano iodio
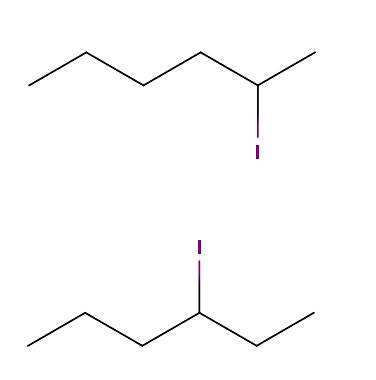
Sopra abbiamo due molecole le cui formule chimiche sono C6H13I. Nel primo abbiamo il 2-iodoesano, mentre nel secondo il 3-iodoesano. Sono isomeri costituzionali di tipo posizionale, poiché lo scheletro è lo stesso, con la differenza che la posizione dell'atomo di iodio varia da un carbonio all'altro..
C3H8O
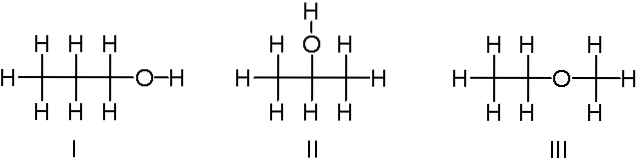
Sopra abbiamo un altro esempio di isomeri costituzionali per la formula chimica C3H8O. Le molecole I e II sono rispettivamente 1-propanolo e 2-propanolo. Sono entrambi alcoli. Invece, la molecola III riguarda l'etil-metil-etere.
Pertanto, parliamo di un altro gruppo funzionale. Nota che le tre molecole hanno lo stesso numero di atomi, ma le loro strutture sono diverse..
2,3-dicloro-2-butene
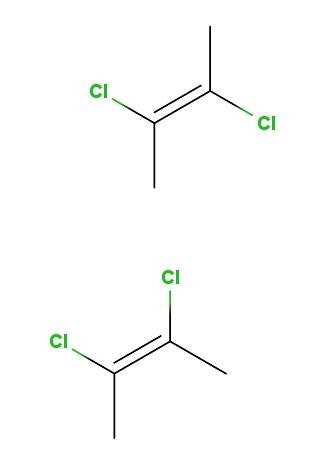
Sopra abbiamo l'isomero trans-2,3-dicloro-2-butene, e sotto abbiamo l'isomero cis-2,3-dicloro-2-butene. Nella prima gli atomi di cloro sono in posizioni opposte rispetto al doppio legame, mentre nella seconda giacciono dalla stessa parte del doppio legame..
La spina dorsale per entrambe le molecole è la stessa, ma differiscono nelle posizioni spaziali degli atomi di cloro; quindi sono stereoisomeri e, poiché non sono immagini speculari, diventano diastereomeri.
3-fluoro-2-metilcicloesano
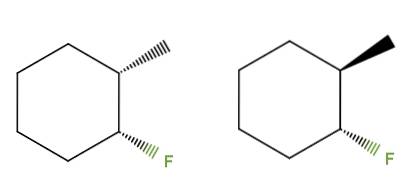
Questa volta, invece di un doppio legame, abbiamo un anello cicloesano per il composto 3-fluoro-2-metilcicloesano. Nell'isomero sinistro, i gruppi CH3 e F sono al di sotto del piano dell'anello; mentre in quello di destra il CH3 è in alto e la F è in basso.
Pertanto, quello a sinistra corrisponderebbe all'isomero cis e quello a destra sarebbe l'isomero trans. Sono quindi diastereomeri, perché ancora una volta non sono immagini speculari.
Conformatori di n-esano
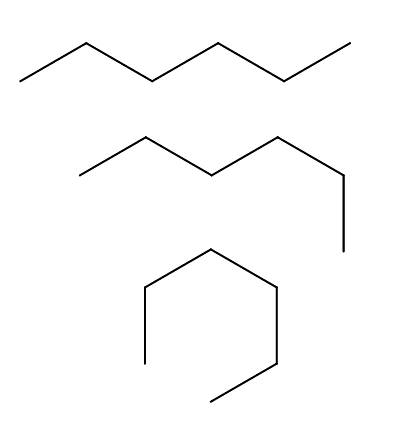
Abbiamo sopra tre conformeri del n-esano, che risultano dalle rotazioni e "pieghe" della catena di carbonio in diversi orientamenti. Corrispondono tutti alla stessa molecola di n-esano con diversi livelli di piegatura, che dipenderanno dall'ambiente e dall'energia interna di ciascuna molecola.
3-bromo-2-pentanolo
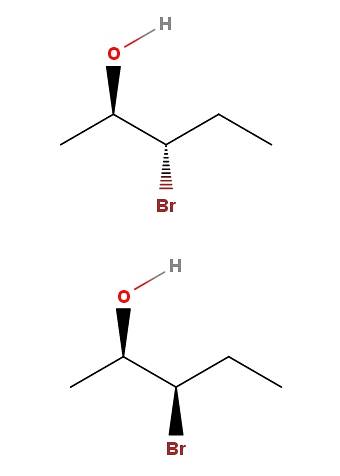
Nel 3-bromo-2-pentanolo abbiamo un altro esempio di una coppia di diastereomeri. Si noti che ancora una volta, nell'isomero sopra abbiamo OH e Br che puntano in direzioni opposte rispetto al piano dello scheletro; mentre nell'isomero inferiore, entrambi i gruppi puntano verso la direzione del lettore.
1-bromo-3-cloro-5-etilcicloesano
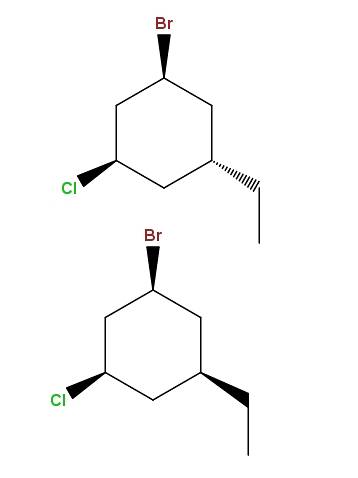
E ancora una volta, abbiamo un'altra coppia di diastereomeri, con la differenza che ora la differenza sta nella posizione spaziale di un singolo gruppo: l'etile, -CHDueCH3.
Questo tipo di isomeri ha un nome ben preciso: epimeri, che sono diastereomeri la cui variazione si osserva solo nella configurazione spaziale di un singolo carbonio asimmetrico; in questo caso, quello legato a -CHDueCH3.
Bromochlorooyodomethane
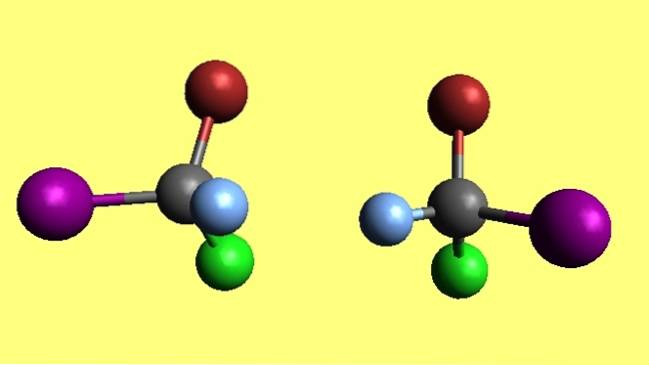
Si noti che le due molecole di bromocloroiodometano, CBrClI, sono enantiomeri perché una è il riflesso non sovrapponibile dell'altra. Non importa quanto ci provi, i suoi quattro atomi non corrisponderanno mai. Si dice che possiedano configurazioni spaziali opposte.
2-bromo-4-etilcicloesano
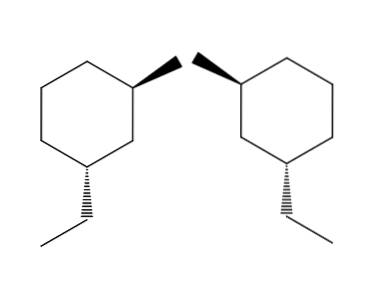
Nell'esempio della coppia di molecole 2-bromo-4-etilcicloesano, l'enantiomeria è ancora più evidente. Se proviamo a capovolgere la molecola a destra, vedremo che il gruppo -CHDueCH3 non si troverà sotto l'anello ma sopra.
Allo stesso modo, il CH3 Non indicherà l'anello ma al di sotto di esso. Le configurazioni spaziali sono invertite, sono opposte. Questa è un'altra delle caratteristiche più importanti dell'enatiomeria..
Rotameri di propilene
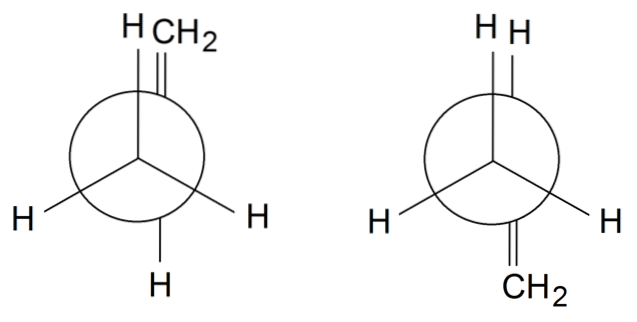
Nei rotameri di propilene, per finire, ruotiamo il legame unico tra C1 e CDue: H3C-CH = CHDue. Il gruppo = CHDue è in una posizione eclissata con una delle H del gruppo CH3 anteriore sul rotametro a sinistra. Nel frattempo, il = CHDue e H sono in posizioni alternate sul rotamero destro.
A seconda dell'eclissi o meno dei gruppi, avremo un ostacolo sterico, che destabilizzerà il rotamero. Pertanto, il rotamero di destra è più stabile di quello di sinistra..
Riferimenti
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. (10th edizione.). Wiley plus.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Dr. S. Gevorg. (2020). Enantiomeri, diastereomeri, isomeri identici o costituzionali. Passaggi di chimica. Estratto da: chemistrysteps.com
- Wikipedia. (2020). Isomero. Estratto da: en.wikipedia.org
- Allison Soult. (13 agosto 2020). Isomeri. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- James Ashenhurst. (2020). Stereochimica e chiralità. Estratto da: masterorganicchemistry.com


Nessun utente ha ancora commentato questo articolo.