
Struttura, funzione e valori normali dell'immunoglobulina D

Il immunoglobulina D (IgD), scoperta nel 1965, è un'immunoglobulina di superficie che si trova (insieme alle IgM) nella membrana dei linfociti B (mIgD) prima della loro attivazione.
Ha la sua funzione di recettore iniziale per gli antigeni. L'IgD è anche libero nel plasma grazie alla sua secrezione (sIgD). Ha un peso molecolare di 185.000 Dalton e rappresenta circa l'1% delle immunoglobuline di un organismo.
Indice articolo
- 1 Cosa sono le immunoglobuline?
- 2 Struttura
- 3 Funzione e malattie
- 3.1 sIgD
- 3.2 mIgD
- 3.3 Linfociti B.
- 3.4 Sistema immunitario infiammatorio
- 4 Valori normali
- 4.1 Concentrazione sierica
- 4.2 Valori del sangue
- 5 Riferimenti
Cosa sono le immunoglobuline?
Le immunoglobuline o gli anticorpi sono glicoproteine globulari complesse altamente specifiche sintetizzate dai linfociti B, cellule responsabili della risposta immunitaria nel corpo degli animali..
Le immunoglobuline interagiscono con molecole che il corpo identifica come non auto o antigeni. Qualsiasi sostanza in grado di attivare la risposta immunitaria nel corpo è chiamata antigene..
La famiglia delle molecole di anticorpi Ig comprende quelle circolanti nel plasma sanguigno e quelle sulla superficie dei linfociti B prima della loro attivazione..
Esistono cinque tipi di immunoglobuline: IgG, IgD, IgE, IgA e IgM (identificate negli esseri umani, topi, cani, rettili, pesci, tra gli altri), che differiscono strutturalmente per le loro regioni costanti nella catena pesante. Queste differenze conferiscono loro particolari proprietà funzionali.
Gli anticorpi agiscono come sensori specifici per gli antigeni. Con questi formano complessi che danno inizio a una cascata di reazioni tipiche del sistema immunitario. Le fasi generali di questo processo sono: riconoscimento, differenziazione di specifici linfociti e infine lo stadio effettore.
Struttura
Tutti gli anticorpi sono molecole polipeptidiche complesse a forma di "Y". Sono costituiti da quattro catene polipeptidiche, due delle quali identiche catene leggere (corte) di circa 214 aminoacidi ciascuna, e le altre due catene pesanti (lunghe) anch'esse identiche tra loro, il doppio degli amminoacidi. Un legame disolfuro collega una catena leggera a una catena pesante.
Entrambi i tipi di catene hanno regioni costanti (caratteristiche del tipo di anticorpo e della specie a cui appartiene l'organismo), dove la sequenza di amminoacidi si ripete da una molecola all'altra, e hanno anche regioni variabili di circa 100 amminoacidi in lunghezza..
Un ponte disolfuro (legame di tipo covalente) unisce ciascuna catena leggera a una catena pesante ea sua volta uno o due di questi legami possono unire le due catene pesanti.
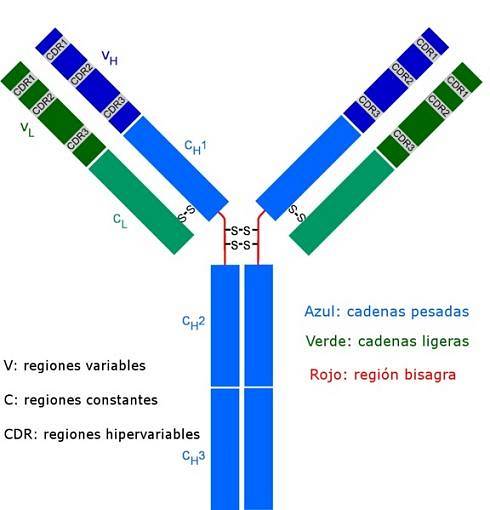
Questi siti sono quelli che si legano come un guanto a una particolare regione dell'antigene specifico, dell'epitopo o del determinante antigenico. La stabilizzazione di questa interazione avviene grazie a numerosi legami non covalenti.
Queste sequenze CDR sono altamente variabili tra gli anticorpi, generando specificità per diversi tipi di antigeni..
Per quanto riguarda le particolarità dell'immunoglobulina D, è noto che presenta un'ampia diversità tra i vertebrati. In generale, è costituito da due catene pesanti delta e due catene leggere. Le IgD sono libere nel siero o legate ai linfociti B attraverso un recettore Fc..
Funzione e malattie
Poiché le IgD sono state preservate evolutivamente dai pesci cartilaginei (che popolavano il pianeta circa 500 milioni di anni fa) agli esseri umani, si ritiene che servano a funzioni immunitarie vitali.
Nonostante ciò, è stata la meno studiata delle immunoglobuline, per le quali non si conoscono ancora esattamente le funzioni specifiche di sIgD nel siero, mentre per mIgD sono state proposte diverse funzioni.
sIgD
Una delle cause del recente interesse per lo studio della sIgD è stata la scoperta di livelli elevati di questa Ig in alcuni bambini con febbre periodica. A sua volta, un altro fattore di interesse è la sua utilità nel monitoraggio dei mielomi..
Si ritiene che la SIgD svolga un ruolo nel sangue, nelle secrezioni mucose e sulla superficie delle cellule effettive immunitarie innate, come i basofili.
Sono altamente reattivi contro i patogeni del sistema respiratorio e i loro prodotti di escrezione. È stato segnalato che le IgD aumentano l'immunità della mucosa, grazie al suo effetto su batteri e virus presenti.
mIgD
Per quanto riguarda mIgD, è considerato un recettore dell'antigene di membrana per i linfociti B, che favorirebbe la maturazione cellulare. A sua volta, si ritiene che sia un ligando per i recettori IgD nell'immunoregolazione delle cellule T helper..
Linfociti B.
Si ritiene che i linfociti B produttori di IgD rappresentino un particolare lignaggio cellulare chiamato linfociti B-1. Questi sono linfociti autoreattivi che sono sfuggiti alla delezione clonale.
Gli autoanticorpi generati da questi linfociti reagiscono con l'acido desossiribonucleico o DNA (a singolo e doppio filamento), con i recettori cellulari, le membrane cellulari dei globuli rossi e il tessuto epiteliale..
È così che generano malattie autoimmuni, come il lupus eritematoso sistemico, la miastenia gravis, anemia emolitica autoimmune e porpora da trombocitopenia idiopatica.
Sistema immunitario infiammatorio
È anche noto che le IgD sono coinvolte nell'orchestrazione di un sistema che interferisce tra il sistema immunitario e quello infiammatorio: alte concentrazioni di IgD sono correlate a disturbi autoinfiammatori (sindrome da iperimmunoglobulemia D, HIDS o iper-IgD).
Ad esempio, in pazienti con condizioni autoimmuni, come l'artrite reumatoide, si riscontrano valori elevati sia di sIgD che di mIgD. Si ritiene quindi che questa condizione contribuisca alla patogenesi della malattia.
Le possibili funzioni di questo anticorpo nelle cellule mononucleate del sangue periferico (PBMC) di questi pazienti sono attualmente allo studio. Tutto ciò ha portato a considerare che le IgD potrebbero essere un potenziale bersaglio immunoterapico nel trattamento dell'artrite reumatoide.
Valori normali
La sIgD negli individui normali varia ampiamente, il che ha reso difficile stabilire un intervallo di riferimento accurato per le loro concentrazioni normali. Alcuni studi hanno dimostrato che questa variazione è particolarmente influenzata da:
- La sensibilità della tecnica di rilevazione applicata - sia mediante saggi radioimmunologici (RIA), saggi immunoenzimatici (EIA) sia quella più comunemente utilizzata nei laboratori clinici che è la radioimmunodiffusione (RID)-.
- L'assenza di un unico metodo universale stabilito per la rilevazione delle IgD.
- Fattori ereditari, razza, età, sesso, stato di gravidanza, abitudine al fumo, tra gli altri
Alcuni specialisti ritengono addirittura che l'analisi di routine delle IgD non sia giustificata, perché il suo ruolo specifico è lungi dall'essere chiarito e i costi della sua analisi nel laboratorio clinico sono elevati. Sarebbe giustificato solo nei casi di pazienti con IgD monoclonali sieriche o sospettati di avere HIDS.
Concentrazione sierica
D'altra parte, è noto che sIgD ha generalmente una concentrazione sierica inferiore a quella di IgG, IgA e IgM, ma superiore alla concentrazione di IgE..
Inoltre, poiché ha un'emivita da 2 a 3 giorni, la concentrazione plasmatica è inferiore all'1% dell'immunoglobulina totale nel siero. Alcune ricerche indicano che rappresenta lo 0,25% delle immunoglobuline sieriche totali.
Valori del sangue
Tra i valori riportati di sIgD nel sangue, nei neonati è stato di 0,08 mg / L (determinato da RIA), nei neonati e negli adulti varia da valori non rilevabili a 400 mg / L (a seconda dell'età e degli individui di ciascuno individuale).
Negli adulti normali sono stati riportati come medie normali 25; 35; 40 e 50 mg / L. In termini generali, la concentrazione sierica media per adulti sani è stata riportata come 30 mg / L (determinata da RID)..
Tuttavia, come discusso in questo articolo, ci sono numerosi fattori che impediscono di stabilire un intervallo di valori normali standard..
Riferimenti
- Chen, K. e Cerutti, A. (2011). La funzione e la regolazione dell'immunoglobulina D. Opinione attuale in immunologia, 23 (3), 345-52.
- Harfi, A. H. e Godwin, J.T. (1985). Livelli sierici normali di IgG, IgA, IgM, IgD e IgE in Arabia Saudita. Annals of Saudi Medicine, Vol 5, No. 2.99-104. doi: 10.5144 / 0256-4947.1985.99
- Josephs, S.H. e Buckley, R.H. (1980). Concentrazioni sieriche di IgD in neonati, bambini e adulti normali e in pazienti con IgE elevate. The Journal of Pediatrics, Vol.96, No.3, pp 417-420.
- Vladutiu, A.O. (2000). Immunoglobulina D: proprietà, misurazione e rilevanza clinica. Immunologia di laboratorio clinica e diagnostica, 7(2), 131-40.
- Voet, J.G. e Voet, W.P.D. (2005). Fondamenti di biochimica: Lyfe a livello molecolare. Wiley. pagg 1361.
- Wu, Y., Chen, W., Chen, H., Zhang, L., Chang, Y., Yan, S., Dai, X., Ma, Y., Huang, Q. e Wei, W. ( 2016). L'elevata immunoglobulina D secreta ha migliorato l'attivazione delle cellule mononucleate del sangue periferico nell'artrite reumatoide. PloS uno, 11 (1). doi: 10.1371 / journal.pone.0147788



Nessun utente ha ancora commentato questo articolo.