
Proprietà, rischi e usi dell'idrossido di bario (Ba (OH) 2)
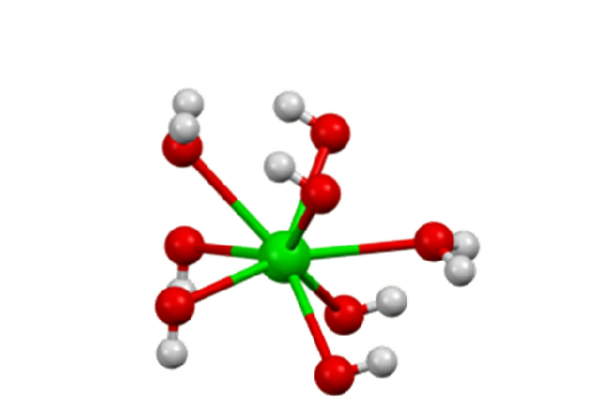
Il idrossido di bario è un composto chimico con la formula Ba (OH)Due(H.DueO)X. È una base forte e può essere in forma anidra, monoidrata o ottoidrata. La forma monoidrata, chiamata anche acqua di barite, è la più comune e commercialmente utilizzata. La struttura dei composti anidri e monoidrati è presentata nella Figura 1.
L'idrossido di bario può essere preparato sciogliendo l'ossido di bario (BaO) in acqua: BaO + 9HDueO → Ba (OH)Due8HDueO. Cristallizza come l'ottaidrato, che diventa il monoidrato quando riscaldato all'aria. A 100 ° C sotto vuoto, il monoidrato produrrà BaO e acqua.
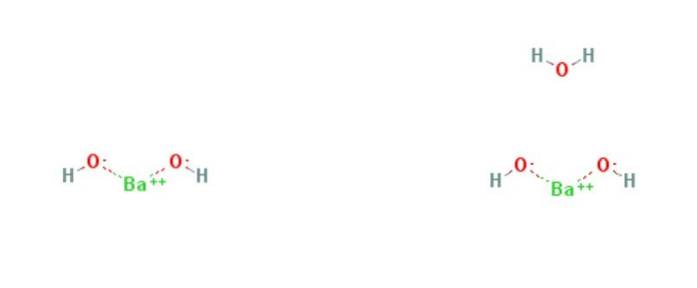
Il monoidrato adotta una struttura a strati (figura 2). I centri BaDue+ adottano una geometria ottaedrica. Ogni centro BaDue+ è legato da due ligandi d'acqua e sei ligandi di idrossido, che sono rispettivamente doppi e tripli collegati ai centri BaDue+ vicinato.
Nell'ottaidrato, il Ba centraDue+ Gli individui sono di nuovo otto coordinate ma non condividono ligandi (idrossido di bario, S.F.).
Indice articolo
- 1 Proprietà dell'idrossido di bario
- 2 Reattività e pericoli
- 2.1 Contatto con gli occhi
- 2.2 Contatto con la pelle
- 2.3 Inalazione
- 2.4 Ingestione
- 3 usi
- 3.1 1- Industria
- 3.2 2- Laboratorio
- 3.3 3- Catalizzatore nella reazione di Wittig-Horner
- 3.4 4- Altri usi
- 4 Riferimenti
Proprietà dell'idrossido di bario
L'idrossido di bario è costituito da cristalli ottaedrici bianchi o trasparenti. Inodore e dal gusto caustico (National Center for Biotechnology Information., 2017). Il suo aspetto è mostrato nella figura 3 (IndiaMART InterMESH Ltd., S.F.).

La forma anidra ha un peso molecolare di 171,34 g / mol, una densità di 2,18 g / ml, un punto di fusione di 407 ° C e un punto di ebollizione di 780 ° C (Royal Society of Chemistry, 2015).
La forma monoidrato ha un peso molecolare di 189,355 g / mol, una densità di 3,743 g / ml e un punto di fusione di 300 ° C (Royal Society of Chemistry, 2015).
La forma ottoidrata ha un peso molecolare di 315,46 g / mol, una densità di 2,18 g / ml e un punto di fusione di 78 ° C (Royal Society of Chemistry, 2015).
Il composto è leggermente solubile in acqua e insolubile in acetone. È una base forte con un pKa di 0,15 e 0,64 per il primo e il secondo OH- rispettivamente.
L'idrossido di bario reagisce in modo simile all'idrossido di sodio (NaOH), ma è meno solubile in acqua. Neutralizza gli acidi esotermicamente per formare sali più acqua. Può reagire con alluminio e zinco per formare ossidi o idrossidi metallici e generare idrogeno gassoso.
Può avviare reazioni di polimerizzazione in composti organici polimerizzabili, in particolare epossidi.
Può generare gas infiammabili e / o tossici con sali di ammonio, nitruri, composti organici alogenati, metalli vari, perossidi e idroperossidi. Le miscele con gengive clorurate esplodono se riscaldate o frantumate (BARIUM HYDROXIDE MONOHYDRATE, 2016).
L'idrossido di bario si decompone in ossido di bario se riscaldato a 800 ° C. La reazione con l'anidride carbonica produce carbonato di bario. La sua soluzione acquosa altamente alcalina subisce reazioni di neutralizzazione con acidi. Pertanto, forma solfato di bario e fosfato di bario con acidi solforico e fosforico, rispettivamente..
HDueSW4 + Ba (OH)Due Baso4 + 2HDueO
La reazione con l'idrogeno solforato produce solfuro di bario. La precipitazione di molti sali di bario insolubili o meno solubili può derivare da una doppia reazione di sostituzione quando una soluzione acquosa di idrossido di bario viene miscelata con molte soluzioni di altri sali metallici..
La miscelazione dell'idrossido di bario solido idrato con cloruro di ammonio solido in un becher produce una reazione endotermica per produrre un liquido, con l'evoluzione dell'ammoniaca. La temperatura scende drasticamente fino a circa -20 ° C (Royal Society of Chemistry, 2017).
Ba (OH)Due (s) + 2NH4Cl (s) → BaClDue (aq) + 2NH3 (g) + HDueO

Ba (OH) 2 reagisce con l'anidride carbonica per produrre carbonato di bario. Questo è espresso dalla seguente reazione chimica:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Reattività e rischi
L'idrossido di bario è classificato come un composto stabile e non combustibile che reagisce rapidamente ed esotermicamente con gli acidi ed è incompatibile con l'anidride carbonica e l'umidità. Il composto è tossico e, come base forte, è corrosivo.
L'inalazione, l'ingestione o il contatto della pelle con il materiale possono causare lesioni gravi o morte. Il contatto con la sostanza fusa può causare gravi ustioni alla pelle e agli occhi..
Evitare il contatto con la pelle. Gli effetti del contatto o dell'inalazione possono essere ritardati. Il fuoco può produrre gas irritanti, corrosivi e / o tossici. Le acque reflue antincendio possono essere corrosive e / o tossiche e causare contaminazione.
Contatto visivo
Se il composto viene a contatto con gli occhi, le lenti a contatto devono essere controllate e rimosse. Sciacquare immediatamente gli occhi con abbondante acqua per almeno 15 minuti, con acqua fredda.
Contatto con la pelle
In caso di contatto con la pelle, l'area interessata deve essere risciacquata immediatamente per almeno 15 minuti con abbondante acqua o un acido debole, ad esempio aceto, rimuovendo gli indumenti e le scarpe contaminati. Copri la pelle irritata con un emolliente.
Lavare indumenti e scarpe prima di riutilizzarli. Se il contatto è grave, lavare con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica..
Inalazione
In caso di inalazione, la vittima deve essere spostata in un luogo fresco. Se non respira, viene praticata la respirazione artificiale. Se la respirazione è difficile, somministrare ossigeno.
Ingestione
Se il composto viene ingerito, il vomito non deve essere indotto. Allenta gli indumenti stretti come il colletto della camicia, la cintura o la cravatta.
In tutti i casi, è necessario ottenere cure mediche immediate (Scheda di sicurezza del materiale Bario idrossido monoidrato, 2013).
Applicazioni
1- Industria
A livello industriale, l'idrossido di bario viene utilizzato come precursore di altri composti di bario. Il monoidrato viene utilizzato per disidratare e rimuovere il solfato da vari prodotti. Questa applicazione sfrutta la bassissima solubilità del solfato di bario. Questa applicazione industriale si applica anche agli usi di laboratorio.
L'idrossido di bario viene utilizzato come additivo nei materiali termoplastici (come le resine fenoliche), nei graffi e negli stabilizzanti in PVC per migliorare le proprietà della plastica. Questo materiale viene utilizzato come additivo generico per lubrificanti e grassi..
Altre applicazioni industriali dell'idrossido di bario includono la produzione di zucchero, la produzione di saponi, la saponificazione dei grassi, la fusione dei silicati e la sintesi chimica di altri composti di bario e composti organici (IDROSSIDO DI BARIO, S.F.).
2- Laboratorio
L'idrossido di bario è utilizzato in chimica analitica per la titolazione di acidi deboli, in particolare acidi organici. La sua soluzione acquosa limpida è garantita come priva di carbonati, a differenza dell'idrossido di sodio e dell'idrossido di potassio poiché il carbonato di bario è insolubile in acqua.
Ciò consente l'uso di indicatori come la fenolftaleina o la timolftaleina (con variazioni di colore alcaline) senza il rischio di errori di titolazione causati dalla presenza di ioni carbonato, che sono molto meno basici (Mendham, Denney, Barnes, & Thomas, 2000).
L'idrossido di bario viene occasionalmente utilizzato nella sintesi organica come base forte, ad esempio per l'idrolisi di esteri e nitrili:
L'idrossido di bario viene anche utilizzato nella decarbossilazione degli amminoacidi che rilasciano carbonato di bario nel processo..
Viene utilizzato anche nella preparazione di ciclopentanone, diacetone alcol e gamma - lattone D - Gulonic.
3- Catalizzatore nella reazione di Wittig-Horner
La reazione di Wittig-Horner, nota anche come reazione di Horner-Wadsworth-Emmons (o reazione HWE) è una reazione chimica utilizzata in chimica organica per stabilizzare i carbanioni fosfonati con aldeidi (o chetoni) per produrre prevalentemente E-alcheni (trans).
La reazione soncochimica di Wittig-Horner è catalizzata da idrossido di bario attivato ed è condotta in condizioni di interfaccia solido-liquido..
Il processo soncochimico avviene a temperatura ambiente e con un peso del catalizzatore e un tempo di reazione inferiori rispetto al processo termico. In queste condizioni si ottengono rese simili a quelle del processo termico..
Nel lavoro di (J. V. Sinisterra, 1987) si analizza l'influenza sull'andamento del tempo di sonicazione, il peso del catalizzatore e del solvente. È necessario aggiungere piccole quantità di acqua affinché la reazione abbia luogo.
Viene analizzata la natura del sito attivo del catalizzatore che agisce nel processo. Viene proposto un meccanismo ETC per il processo sonochimico.
4- Altri usi
L'idrossido di bario ha altri usi. Viene utilizzato per una serie di scopi, come ad esempio:
- La produzione di alcali.
- Costruzione in vetro.
- Vulcanizzazione della gomma sintetica.
- Inibitori di corrosione.
- Come fluidi di perforazione, pesticidi e lubrificanti.
- Per il rimedio della caldaia.
- Per raffinare oli vegetali e animali.
- Per la pittura ad affresco.
- Nell'addolcimento dell'acqua.
- Come ingrediente nei rimedi omeopatici.
- Per pulire fuoriuscite di acido.
- Viene anche utilizzato nell'industria dello zucchero per preparare lo zucchero di barbabietola.
- Materiali di costruzione.
- Prodotti elettrici ed elettronici.
- Rivestimenti per pavimenti.
Riferimenti
- BARIO IDROSSIDO MONOIDRATO. (2016). Estratto da cameochemicals: cameochemicals.noaa.gov.
- Idrossido di bario. (S.F.). Estratto da chemistrylearner: chemistrylearner.com.
- IDROSSIDO DI BARIO. (S.F.). Estratto da chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd… (S.F.). Idrossido di bario. Recupero da indiamart: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 come catalizzatore nelle reazioni organiche. 17. Reazione di Wittig-Horner solido-liquido interfacciale in condizioni sonochimiche. The Journal of Organic Chemistry 52 (17), 3875-3879. researchgate.net.
- Scheda di sicurezza del materiale Idrossido di bario monoidrato. (2013, 21 maggio). Estratto da sciencelab: sciencelab.com/msds.
- Mendham, J., Denney, R. C., Barnes, J. D. e Thomas, M. J. (2000). Analisi chimica quantitativa di Vogel's (6a ed.). New York: Prentice Hall.
- Centro nazionale per le informazioni sulla biotecnologia. (28 marzo 2017). Database composto di PubChem; CID = 16211219. Recupero da PubChem: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Idrossido di bario. Estratto da chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Idrossido di bario idrato (1: 2: 1). Estratto da chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Diidrossibario idrato (1: 1). Estratto da chemspider: chemspider.com.
- Royal Society of Chemistry. (2017). Reazioni endotermiche solido-solido. Estratto da: learn-chemistry: rsc.org.



Nessun utente ha ancora commentato questo articolo.