
Proprietà, reattività e usi dell'idruro di calcio (CaH2)

Il idruro di calcio È un composto chimico con la formula CaH2, che lo rende un idruro alcalino terroso. Questo composto chimico ha due legami ionici tra il calcio e i due ioni idruro, come mostrato nella figura 1.
È un idruro salino, il che significa che la sua struttura è simile al sale. La sua struttura cristallina è la stessa di quella del cloruro di piombo (minerale di cotunnite) come mostrato in figura 2.
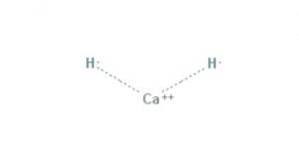
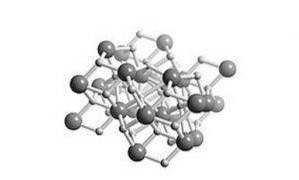
Tutti i metalli alcalini e alcalino terrosi formano sali di idruro. In chimica, un idruro è l'anione dell'idrogeno, H- o, più comunemente, è un composto in cui uno o più centri di idrogeno hanno proprietà nucleofile, riducenti o basiche.
Nei composti che sono considerati idruri, l'atomo di idrogeno è attaccato a un elemento o gruppo più elettropositivo.
Può essere prodotto facendo reagire calcio e idrogeno a una temperatura compresa tra 300 e 400 gradi Celsius. Un altro modo per preparare l'idruro di calcio è riscaldare il cloruro di calcio insieme all'idrogeno e al sodio metallico. La reazione avviene come segue:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
In questa reazione, il calcio (Ca) e l'idrogeno (H) creano una molecola di idruro di calcio mentre gli atomi di sodio insieme al cloro creano molecole di cloruro di sodio (NaCl)..
L'idruro di calcio può anche essere prodotto riducendo l'ossido di calcio (CaO) con magnesio (Mg). La reazione viene condotta in presenza di idrogeno. Questa reazione produce anche ossido di magnesio (MgO). Di seguito è riportata la formula per questa reazione chimica:
CaO + Mg + H2 → CaH2 + MgO
Indice articolo
- 1 Proprietà fisiche e chimiche dell'idruro di calcio
- 2 Reattività e pericoli
- 3 Manipolazione e immagazzinamento
- 4 Usi e applicazioni
- 4.1 Agente essiccante
- 4.2 Produzione di idrogeno
- 4.3 Agente riducente
- 5 Svantaggio nell'uso dell'idruro di calcio
- 6 Riferimenti
Proprietà fisiche e chimiche dell'idruro di calcio
L'idruro di calcio è un insieme di cristalli con una struttura ortorombica di colore bianco quando puro. Generalmente, è raro trovarlo in questa forma, quindi di solito ha una tonalità grigiastra. Manca un odore caratteristico. Il suo aspetto è mostrato nella figura 3 (Royal Society of Chemistry, 2015).

Ha un peso molecolare di 42,094 g / mol, ha un punto di fusione di 816 gradi Celsius e una densità di 1,70 g / ml. Se si dissolve in acqua reagisce violentemente producendo idrogeno. Reagisce anche con l'alcol (National Center for Biotechnology Information., S.F.).
Reattività e rischi
L'idruro di calcio è una sostanza chimica stabile, sebbene sia altamente reattiva all'acqua o all'umidità. A contatto con l'acqua rilascia gas idrogeno infiammabili che possono infiammarsi spontaneamente.
È considerato un composto esplosivo. Se riscaldato in una reazione con tetraidrofurano, può causare un'esplosione. Se miscelato con clorato, ipoclorito, bromato, perclorato di potassio, diventa sensibile al calore, all'attrito e diventa esplosivo (Calcium Hydride 7789-78-8, 2016).
Quando il fluoruro d'argento viene schiacciato con idruro di calcio, la massa diventa incandescente. Il forte riscaldamento dell'idruro con cloro, bromo o iodio porta all'incandescenza.
Miscele dell'idruro con vari bromati, ad esempio bromato di bario o clorati, ad esempio clorato di bario e perclorati come il perclorato di potassio, esplodono durante la macinazione. CaH2 reagisce in modo incandescente con fluoruro d'argento se soggetto ad attrito.
Questo composto deve essere maneggiato in un'atmosfera inerte. Se non gestito correttamente, può rappresentare una seria minaccia per la salute e la sicurezza del personale di laboratorio, dei primi soccorritori e dei gestori di rifiuti chimici (UC center for Laboratory Safety, 2013).
Estremamente pericoloso in caso di contatto con la pelle o gli occhi, in quanto irritante. Molto pericoloso in caso di contatto con la pelle in quanto può essere corrosivo.
È anche pericoloso in caso di ingestione e inalazione. L'entità del danno tissutale dipende dalla lunghezza del contatto. Il contatto con gli occhi può provocare danni alla cornea o cecità..
Il contatto con la pelle può causare infiammazioni e vesciche. L'inalazione di polvere provoca irritazione del tratto gastrointestinale o respiratorio, caratterizzata da bruciore, starnuti e tosse..
Una grave sovraesposizione può causare danni ai polmoni, soffocamento, perdita di coscienza e persino la morte. L'infiammazione degli occhi è caratterizzata da arrossamento, lacrimazione e prurito. L'infiammazione della pelle è caratterizzata da prurito, desquamazione, arrossamento o occasionalmente vesciche.
L'esposizione oculare ripetuta a basso livello può causare irritazione agli occhi. L'esposizione ripetuta della pelle può causare la distruzione locale della pelle o dermatiti..
L'inalazione ripetuta di polvere può produrre vari gradi di irritazione respiratoria o danni ai polmoni. L'inalazione ripetuta o prolungata di polvere può causare irritazione respiratoria cronica (Scheda di sicurezza del materiale idruro di calcio MSDS, 2005).
In caso di contatto con gli occhi, sciacquarli immediatamente con abbondante acqua per almeno 15 minuti, sollevando di tanto in tanto le palpebre superiori e inferiori..
In caso di contatto con la pelle, sciacquare immediatamente con abbondante acqua per almeno 15 minuti rimuovendo gli indumenti e le scarpe contaminati..
In caso di ingestione, il vomito non deve essere indotto. Dovrebbe essere chiamato un centro antiveleni. Si consiglia di lasciare il luogo di esposizione e di spostarsi immediatamente all'aria aperta.
In caso di inalazione, se la respirazione è difficoltosa è necessario fornire ossigeno. La rianimazione bocca a bocca non deve essere eseguita se la vittima ha ingerito o inalato la sostanza..
La respirazione artificiale deve essere indotta con l'ausilio di una maschera tascabile dotata di valvola unidirezionale o altro dispositivo medico respiratorio idoneo. In tutti i casi, consultare immediatamente un medico..
Manipolazione e stoccaggio
Il composto va conservato in un contenitore asciutto, lontano da fonti di calore. Dovrebbe essere tenuto lontano da fonti di accensione. La polvere non deve essere respirata. Non aggiungere acqua a questo prodotto
In caso di ventilazione insufficiente, indossare un'attrezzatura respiratoria adatta come una maschera con filtro. In caso di esposizione, consultare un medico e, ove possibile, esporre l'etichetta. Evitare il contatto con la pelle e gli occhi.
I materiali infiammabili, in generale, devono essere conservati in un armadio di sicurezza separato o in un ripostiglio. Tieni il contenitore chiuso ermeticamente.
Conservare in un luogo fresco e ben ventilato. Tutte le apparecchiature contenenti materiale devono essere messe a terra per evitare scintille elettriche. Il contenitore deve essere mantenuto asciutto e in un luogo fresco.
È un materiale non infiammabile. Tuttavia, i vigili del fuoco dovrebbero indossare attrezzature adeguate mentre combattono un incendio intorno a questo composto chimico..
Non è mai consigliabile utilizzare l'acqua per spegnere un incendio intorno all'idruro di calcio. A tale scopo è possibile utilizzare sabbia asciutta e composti come cloruro di sodio e carbonato di sodio..
Per rimuovere l'idruro di calcio di scarto, deve essere decomposto aggiungendo 25 ml di metanolo per ogni grammo di idruro sotto un'atmosfera di azoto mentre si agita..
Una volta completata la reazione, lo stesso volume di acqua viene aggiunto al composto acquoso di metossido di calcio e viene smaltito nello scarico con abbondante acqua (consiglio nazionale delle ricerche, 1995).
Usi e applicazioni
Agente essiccante
L'idruro di potassio è un essiccante relativamente mite. Per questo motivo, l'uso di questo composto come essiccante è più sicuro rispetto ad agenti più reattivi, come le leghe di sodio-potassio e metalli di sodio. Reagisce con l'acqua come segue:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
I prodotti di idrolisi di questa reazione, idrogeno (gas) e Ca (OH) 2 (una miscela acquosa), possono essere separati dal solvente chimico seguendo un processo di filtrazione, distillazione o decantazione..
Questo composto chimico è un essiccante efficace per molti solventi di base come ammine e piridina. A volte viene utilizzato per pre-essiccare i solventi prima di utilizzare essiccanti più reattivi.
Produzione di idrogeno
Negli anni '40, questo composto era disponibile come fonte di idrogeno con il nome commerciale "Hydrolith"..
È stato utilizzato come fonte di idrogeno per molto tempo. È ancora utilizzato per produrre idrogeno puro nei laboratori per vari esperimenti, celle a combustibile avanzate e applicazioni per batterie (American Elements, S.F.).
Il composto è stato ampiamente utilizzato per decenni come mezzo sicuro e conveniente per gonfiare i palloni meteorologici..
Viene anche usato regolarmente nei laboratori per produrre piccole quantità di idrogeno altamente puro per esperimenti. Il contenuto di umidità del gasolio è calcolato dall'idrogeno sviluppato dopo il trattamento con CaH2.
Agente riducente
Quando riscaldato tra 600 e 1000 gradi centigradi, l'ossido di zirconio, il niobio, l'uranio, il cromo, il titanio, il vanadio e il tantalio possono essere ridotti per preparare la polvere di questi metalli, quindi l'idruro di calcio può essere utilizzato nella metallurgia della polvere.
La seguente reazione illustra come l'idruro di calcio agisce come agente riducente:
TiO + 2CaH2 → CaO + H2 + Ti
Svantaggio nell'uso dell'idruro di calcio
Questo composto chimico è spesso la scelta preferita come agente essiccante; Tuttavia, presenta anche alcuni svantaggi:
-L'azione essiccante di questo composto è lenta, poiché non è solubile in nessun solvente con cui non reagisce violentemente..
-Questo composto in polvere è incompatibile con molti solventi. La sua reazione con i clorocarburi può persino provocare esplosioni.
-Non può essere utilizzato per deossigenare solventi in quanto non è in grado di rimuovere l'ossigeno disciolto.
-La differenziazione tra idruro di calcio e idrossido di calcio è abbastanza difficile a causa delle loro apparenze simili.
Riferimenti
- Elementi americani. (S.F.). idruro di calcio. Estratto da americanelements.com: americanelements.com.
- Idruro di calcio 7789-78-8. (2016). Estratto da chemicalbook.com: chemicalbook.com.
- idruro di calcio. (s.f.). Estratto dallo studente di chimica: chemistrylearner.com.
- Scheda di sicurezza del materiale Idruro di calcio MSDS. (2005, 10 ottobre). Estratto da sciencelab.com: sciencelab.com.
- Centro nazionale per le informazioni sulla biotecnologia. (S.F.). Database composto di PubChem; CID = 105052. Estratto da pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- Consiglio Nazionale per la Ricerca. (Millenovecentonovantacinque). Pratiche prudenti in laboratorio: manipolazione e smaltimento di prodotti chimici. Washinton: NationalAacademy Press.
- Royal Society of Chemistry. (2015). ID idruro di calcio 94784. Estratto da chemspider.com: chemspider.com.
- Centro UC per la sicurezza del laboratorio. (2013, 18 gennaio). procedura operativa standard idruro di calcio. Estratto da chemengr.ucsb.edu: chemengr.ucsb.edu.



Nessun utente ha ancora commentato questo articolo.