
Proprietà fisiche e chimiche dell'esano (C6H14), struttura, usi, tossicità
Il esano è un idrocarburo caratterizzato dal fatto di essere un composto organico la cui formula chimica condensata è C6H14. È un liquido incolore e trasparente che non può essere miscelato con acqua. Ha cinque isomeri, quello lineare è uno degli idrocarburi paraffinici più importanti nell'industria e nella ricerca.
L'esano è ottenuto per distillazione frazionata del petrolio greggio. Allo stesso modo, è naturalmente presente negli agrumi e in frazioni volatili di varie piante o frutti come mela, guava, nocciole tostate, patata dolce e salvia..
È un liquido volatile altamente infiammabile che si trova nella benzina, nelle colle ad asciugatura rapida e nel cemento per gomma. L'esano è utilizzato come solvente nel processo di estrazione di oli vegetali, lipidi e grassi presenti in acqua e suoli contaminati.
Le persone che sono professionalmente esposte all'esano possono subire danni al sistema nervoso periferico, manifestati da formicolio e crampi alle gambe e alle braccia; oltre alla debolezza muscolare generalizzata e, nei casi più gravi, all'atrofia muscolare scheletrica.
Indice articolo
- 1 Proprietà fisiche e chimiche degli esani
- 1.1 Aspetto fisico
- 1.2 Massa molare
- 1.3 Odore
- 1.4 Soglia di odore
- 1.5 Densità
- 1.6 Punto di fusione
- 1.7 Punto di ebollizione
- 1.8 Punto di infiammabilità
- 1.9 Solubilità in acqua
- 1.10 Solubilità nei solventi
- 1.11 Densità relativa del vapore con aria
- 1.12 Coefficiente di ripartizione ottanolo / acqua
- 1.13 Pressione di vapore
- 1.14 Lunghezza d'onda della massima densità ottica
- 1.15 Indice di rifrazione
- 1.16 Viscosità
- 1.17 Capacità calorica
- 1.18 Calore di combustione
- 1.19 Calore di vaporizzazione
- 1.20 Tensione superficiale
- 1.21 Potenziale di ionizzazione
- 1.22 Stabilità
- 1.23 Reattività
- 2 Struttura dell'esano
- 2.1 Interazioni intermolecolari
- 2.2 Isomeri
- 3 usi
- 4 Tossicità
- 4.1 Inalazione e contatto
- 4.2 Dose sicura
- 5 Riferimenti
Proprietà fisiche e chimiche degli esani
Aspetto fisico
Liquido incolore, trasparente e altamente volatile.
Massa molare
86,178 g / mol
Odore
Simile alla benzina
Soglia di odore
1,5 ppm
Densità
0,6606 g / mL
Punto di fusione
-Da 96 a -94 ºC
Punto di ebollizione
Da 68,5 a 69,1 ºC
punto di accensione
-22 ºC (vaso chiuso).
Solubilità dell'acqua
9,5 mg / L (praticamente immiscibile con acqua)
Solubilità in solventi
Molto solubile in etanolo, solubile in etere etilico e cloroformio. Miscibile con alcool, cloroformio ed etere.
Densità relativa del vapore con l'aria
2.97 (aria = 1)
Coefficiente di ripartizione ottanolo / acqua
Log P = 3,764
Pressione del vapore
17,60 kPa a 20 ºC
Lunghezza d'onda della massima densità ottica
200 nm
Indice di rifrazione
1.375
Viscosità
0,3 mPa s
Capacità calorica
265.2 JK-1Talpa-1
Calore di combustione
4.163,2 kJ mol-1
Calore di vaporizzazione
31,56 kJ mol-1
Tensione superficiale
17,89 mN / ma 25 ºC
Potenziale di ionizzazione
10.18 eV
Stabilità
Stabile. Incompatibile con agenti ossidanti, cloro, fluoro, perclorato di magnesio. Forma una miscela esplosiva con l'aria.
Reattività
L'esano può reagire vigorosamente con i materiali ossidanti, che possono includere cloro liquido, ossigeno concentrato, ipoclorito di sodio e ipoclorito di calcio. È anche incompatibile con il tetrossido di diazoto. L'esano può attaccare alcune forme di plastica, gomma e rivestimenti.
Struttura dell'esano
Interazioni intermolecolari
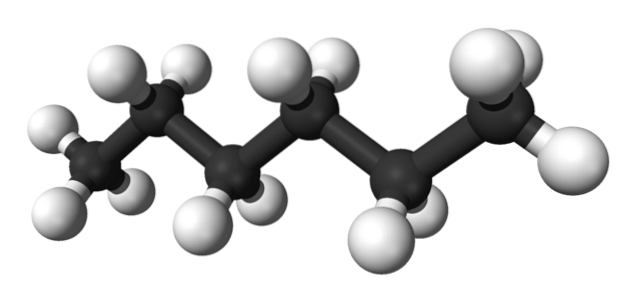
La prima immagine mostra la molecola di n-esano rappresentato da un modello a palla e bastone. Le sfere nere corrispondono agli atomi di carbonio, che compongono lo scheletro di carbonio a zig-zag, mentre le sfere bianche sono gli atomi di idrogeno. Il n-L'esano è quindi un idrocarburo, lineare e altamente dinamico.
Poiché tutti i suoi legami C-H sono di bassa polarità, alla molecola manca un momento di dipolo. In tal modo, le loro interazioni intermolecolari non sono di tipo dipolo-dipolo, ma dipendono esclusivamente dalla massa molecolare e dalle forze dispersive di Londra..
Ogni molecola di n-L'esano "si incastra" uno sull'altro a temperature molto basse, come si presume nella sua struttura cristallina. D'altra parte, nel liquido i loro scheletri flettono e ruotano i loro legami C-H, facendo sì che detto liquido sia volatile e bolle a 68,7 ºC..
Isomeri
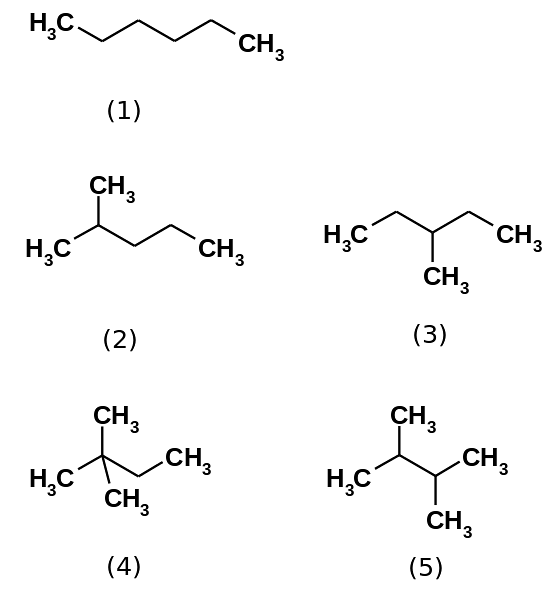
L'idrocarburo esano consiste in realtà di cinque isomeri, essendo il n-esano il meno ramificato, (1). Gli altri quattro isomeri sono, in ordine crescente:
2-metilpropano (2)
3-metilpropano (3)
2,2-dimetilbutano (4)
2,3-dimetilbutano (5)
Si noti inoltre che le strutture diventano più ramificate da (1) a (5). Essendo più ramificate, le forze dispersive diminuiscono, poiché non ci sono più porzioni lineari che si incuneano in modo efficiente. Questo porta ad una diminuzione e variazione dei punti di ebollizione degli isomeri; sebbene si osservino alcune discrepanze accettabili.
Sia il 2-metilpropano (bp = 60,3 ° C) che il 3-metilpropano (bp = 63,3 ° C) sono ugualmente ramificati, ma i loro punti di ebollizione sono diversi. Quindi è seguito da 2,3-dimetilbutano (peb = 58 ºC), per individuare finalmente il 2,2-dimetilbutano come il liquido più volatile (peb = 49,7 ºC).
Applicazioni
L'esano viene miscelato con sostanze chimiche simili per produrre solventi. Tra i nomi dati a questi solventi ci sono esano commerciale, esani misti, ecc. Sono utilizzati come detergenti nell'industria tessile, del mobile e della stampa rotocalco..
L'esano è un ingrediente delle colle utilizzate per l'impermeabilizzazione dei tetti, le calzature e la pelle. Viene anche utilizzato per rilegare libri, modellare pillole e compresse, inscatolare, fabbricare pneumatici e palle da baseball..
L'esano viene utilizzato nella determinazione dell'indice di rifrazione dei minerali e del liquido di riempimento per termometri al posto del mercurio; di solito con una tinta rossa o blu. Viene anche utilizzato nell'estrazione di grassi e oli dall'acqua per l'analisi dei suoi contaminanti..
L'esano è usato come solvente nell'estrazione dell'olio dai semi vegetali, come la soia, la colza o la mora. Inoltre, viene utilizzato per sgrassare parti di diversa origine. Viene utilizzato nella denaturazione dell'alcol, nel metodo di analisi HPLC e nella spettrofotometria.
Tossicità
Inalazione e contatto
La tossicità acuta dell'esano è relativamente bassa, sebbene sia un lieve anestetico. L'esposizione acuta ad alte concentrazioni di esano può produrre, per inalazione, lieve depressione del sistema nervoso centrale (SNC), manifestata da capogiri, vertigini, lieve nausea e mal di testa..
Può anche causare dermatiti e irritazioni agli occhi e alla gola. L'inalazione cronica di esano, correlata all'attività lavorativa, può provocare danni al sistema nervoso periferico (polineuropatia sensomotoria).
I sintomi iniziali sono formicolio e crampi alle gambe e alle braccia, seguiti da debolezza muscolare. Nei casi più gravi, può verificarsi atrofia del muscolo scheletrico, insieme a perdita di coordinazione e problemi di vista.
La tossicità dell'esano è correlata alla generazione del metabolita esano-2,5-dione. Reagisce con l'amminoacido lisina di una catena laterale proteica, provocando la perdita della funzione proteica..
Dose sicura
L'Enviromental Protection Agency (EPA) ha calcolato una concentrazione di riferimento (RfC) per esano di 0,2 mg / m3, e una dose di riferimento (RfD) di 0,06 mg / kg di peso corporeo / giorno.
Negli anni '60 e '70, un gruppo di lavoratori dell'industria calzaturiera in Giappone aveva la presenza di disturbi nervosi. La causa era che hanno respirato in un'atmosfera di esano di 500 - 2.500 ppm, per 8-14 ore al giorno.
Gli operai hanno mostrato i noti sintomi dell'inalazione cronica di esano, scoprendo i medici che i nervi che controllavano i muscoli delle braccia e delle gambe erano danneggiati..
Riferimenti
- Danielle Reid. (2019). Esano: struttura, formula e proprietà. Studia. Estratto da: study.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Esano. Database PubChem. CID = 8058. Estratto da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Esano. Estratto da: en.wikipedia.org
- Mondo delle molecole. (s.f.). Molecola di esano. Estratto da: worldofmolecules.com
- Libro chimico. (2017). Esano. Estratto da: chemicalbook.com
- Il commonwealth dell'Australia. (s.f.). n-Esano: Fonti di emissioni. Estratto da: npi.gov.au
- EPA. (2000). Esano. [PDF]. Estratto da: epa.gov
- Agenzia per le sostanze tossiche e il registro delle malattie. (1999). Dichiarazione di sanità pubblica per n-esano. Recupero da: atsdr.cdc.gov


Nessun utente ha ancora commentato questo articolo.