
Storia, proprietà, struttura, ottenimento, usi del fosforo
Il incontro È un elemento non metallico che è rappresentato dal simbolo chimico P e ha numero atomico 15. Ha tre forme allotropiche principali: fosforo bianco, rosso e nero. Il fosforo bianco è fosforescente, brucia spontaneamente se esposto all'aria ed è anche altamente velenoso..
Il fosforo bianco alla temperatura di 250 ºC diventa fosforo rosso; una forma polimerica insolubile che non brucia nell'aria. Ad alte temperature e pressioni, così come in presenza o meno di catalizzatori, si ottiene fosforo nero, che assomiglia alla grafite ed è un buon conduttore di elettricità..

Il fosforo fu isolato per la prima volta da H. Brand nel 1669. Per questo usò l'urina come fonte di questo elemento. Nel 1770, W. Scheele scoprì che poteva anche isolare il fosforo dalle ossa.
Successivamente, grazie alla creazione del forno elettrico da parte di J. Burgess Readman (1800), le rocce fosfatiche divennero la principale fonte di produzione di fosforo dal minerale fluoroapatite, presente in esse..
Il fosforo è il dodicesimo elemento più abbondante nella crosta terrestre, rappresentando lo 0,1% in peso. Inoltre, è il sesto elemento in abbondanza nel corpo umano; concentrato principalmente nelle ossa sotto forma di idrossiapatite.
È quindi un elemento essenziale per gli esseri viventi, diventando uno dei tre principali nutrienti delle piante. Il fosforo fa parte della struttura chimica degli acidi nucleici; di composti di accumulo di energia (ATP), coenzimi; e in generale, dei composti del metabolismo.
Indice articolo
- 1 Storia
- 1.1 - Scoperta
- 1.2 - Sviluppo industriale
- 2 Proprietà fisiche e chimiche
- 2.1 Aspetto
- 2.2 Peso atomico
- 2.3 Numero atomico (Z)
- 2.4 Punto di fusione
- 2.5 Punto di ebollizione
- 2.6 Densità (temperatura ambiente)
- 2.7 Calore di fusione
- 2.8 Calore di vaporizzazione
- 2.9 Capacità termica molare
- 2.10 stati di ossidazione
- 2.11 Elettronegatività
- 2.12 Energia di ionizzazione
- 2.13 Conduttività termica
- 2.14 Ordine magnetico
- 2.15 Isotopi
- 2.16 Fosforescenza
- 2.17 Cambiamenti allotropici
- 2.18 Solubilità
- 2.19 Reattività
- 3 Struttura e configurazione elettronica
- 3.1 - Collegamenti e unità tetraedrica
- 3.2 - Allotropi
- 4 Dove trovare e ottenere
- 4.1 Apatite e fosforite
- 4.2 Riduzione elettrotermica della fluoroapatite
- 5 leghe
- 5.1 Rame
- 5.2 Bronzo
- 5.3 Nichelato
- 6 Rischi
- 7 Usi
- 7.1 - Fosforo elementare
- 7.2 - Composti
- 8 Riferimenti
Storia
- Scoperta
Nelle urine

Il fosforo fu isolato da Henning Brand nel 1669, essendo il primo essere umano a isolare un elemento. Brand era un alchimista tedesco di Amburgo e riuscì a ottenere un composto di fosforo dall'urina. Per fare questo, ha raccolto l'urina da 50 secchi e l'ha lasciata decomporre.
Brand quindi evaporò l'urina e ottenne un residuo nerastro, che conservò per diversi mesi. A questo aggiunse sabbia e la riscaldò, riuscendo ad eliminare gas e oli. Infine, ha ottenuto un solido bianco che brillava al buio con un colore verde, che ha chiamato "fuoco freddo"..
Il termine "fosforo", guarda caso, deriva dalla parola greca "Phosphoros" che significa portatore di luce..
Brand non pubblicò i suoi risultati sperimentali e li vendette a vari alchimisti, tra cui: Johann Kraft, Kunckel Lowenstern e Wilhelm Leibniz. Probabilmente, alcuni di loro hanno segnalato il lavoro di Brand all'Accademia delle scienze di Parigi, diffondendo così la loro ricerca.
Tuttavia, Brand non ha effettivamente isolato il fosforo, ma l'ammoniaca fosfato di sodio [Na (NH4) PO4]. Nel 1680, Robert Boyle migliorò la procedura di Brand, grazie alla quale fu in grado di ottenere una forma allotropica di fosforo (P4).
Nelle ossa
Johan Gottlieb Gahn e Carl Wihelm Scheele stabilirono nel 1769 che nelle ossa era stato trovato un composto di fosforo, il fosfato di calcio. Le ossa sgrassate sono state sottoposte a un processo di digestione con acidi forti, come l'acido solforico.
Quindi il prodotto della digestione è stato riscaldato in contenitori di acciaio con carbone e carbone, ottenendo così fosforo bianco per distillazione in storte. Le ossa furono la principale fonte di fosforo fino al 1840, quando furono sostituite a questo scopo dal guano..
Nel guano
Il guano è una miscela di escrementi di uccelli e prodotti di decomposizione degli uccelli. È stato utilizzato come fonte di fosforo e fertilizzanti nel XIX secolo.
- Sviluppo industriale
Le rocce fosfatiche vennero utilizzate nel 1850 come fonte di fosforo. Questo, insieme all'invenzione del forno elettrico per calcinazione delle rocce di James Burgess Readman (1888), fece delle rocce fosfatiche la principale materia prima per la produzione di fosforo e fertilizzanti..
Nel 1819 furono fondate le fabbriche di fiammiferi, dando inizio allo sviluppo industriale dell'uso del fosforo..
Proprietà fisiche e chimiche
Aspetto
A seconda della forma allotropica, può essere incolore, bianco ceroso, giallo, scarlatto, rosso, viola o nero.
Peso atomico
30.973 u
Numero atomico (Z)
quindici
Punto di fusione
Fosforo bianco: 44,15 ºC
Fosforo rosso: ~ 590 ºC
Punto di ebollizione
Fosforo bianco: 280,5 ºC
Densità (temperatura ambiente)
Bianco: 1.823 g / cm3
Rosso: 2,2-2,34 g / cm3
Viola: 2,36 g / cm3
Nero: 2,69 g / cm3
Calore di fusione
Fosforo bianco: 0,66 kJ / mol
Calore di vaporizzazione
Fosforo bianco: 51,9 kJ / mol
Capacità termica molare
Fosforo bianco: 23,824 J / (mol.K)
Stati di ossidazione
-3, -2, -1, +1, +2, +3, +4 e +5
A seconda dell'elettronegatività degli elementi con cui si combina, il fosforo può mostrare lo stato di ossidazione +3 o -3. Il fosforo, a differenza dell'azoto, tende a reagire preferenzialmente con lo stato di ossidazione +5; tale è il caso del pentossido di fosforo (PDueO5 o PDue5+O5Due+).
Elettronegatività
2.19 della scala Pauling
Energia ionizzata
-Primo: 1.101 kJ / mol
-Secondo: 2.190,7 kJ / mol
-Terzo: 2.914 kJ / mol
Conduttività termica
Fosforo bianco: 0,236 W / (mK)
Fosforo nero: 12,1 W / (mK)
Mostra come il fosforo nero conduce quasi sei volte più calore del fosforo bianco.
Ordine magnetico
I fosfori bianchi, rossi, viola e neri sono diamagnetici.
Isotopi
Il fosforo ha 20 isotopi, i principali sono: 31P, l'unico isotopo stabile con un'abbondanza del 100%; 32P, isotopo emittente β- e con un'emivita di 14,28 giorni; Y 33P, un isotopo che emette β- e con un'emivita di 25,3 giorni.
Fosforescenza
Il fosforo bianco è fosforescente ed emette una luce verde nell'oscurità.
Cambiamenti allotropici
Il fosforo bianco è instabile e cambia a temperature vicine ai 250ºC in una forma polimerica nota come fosforo rosso, che può variare dal colore arancione al viola. È una sostanza amorfa, ma può diventare cristallina; non si illumina al buio e non brucia nell'aria.
Il fosforo bianco ad alte temperature e pressioni, o in presenza di catalizzatori, si trasforma in una forma polimerica diversa dal fosforo rosso: fosforo nero. Questa è una sostanza cristallina di colore nero, inerte, simile alla grafite, e che ha la capacità di condurre l'elettricità.
Solubilità
Il fosforo bianco in forma pura è insolubile in acqua, sebbene possa essere solubilizzato in solfuro di carbonio. Nel frattempo, i fosfori rossi e neri sono insolubili in acqua e sono meno volatili del fosforo bianco..
Reattività
Il fosforo brucia spontaneamente nell'aria per formare PDueO5, e questo a sua volta può reagire con tre molecole di acqua per formare acido ortofosforico o fosforico (H3PO4).
Attraverso l'azione dell'acqua calda, la fosfina (PH3) e ossacidi di fosforo.
L'acido fosforico agisce sulle rocce fosfatiche, causando diidrogeno calcio fosfato o perfosfato [Ca (HDuePO4)Due].
Può reagire con gli alogeni per formare alogenuri PX3, X che rappresenta F, Cl, Br o I; o alogenuri con formula PX5, dove X è la F, Cl o Br.
Inoltre, il fosforo reagisce con metalli e metalloidi per formare fosfuri e con lo zolfo per formare vari solfuri. D'altra parte, si lega all'ossigeno per creare esteri. Allo stesso modo, si combina con il carbonio per formare composti organici fosforosi..
Struttura e configurazione elettronica
- Legami e unità tetraedrica
Gli atomi di fosforo hanno la seguente configurazione elettronica:
[Ne] 3sDue 3p3
Ha quindi cinque elettroni di valenza, come l'azoto e gli altri elementi del gruppo 15. Poiché è un elemento non metallico, i suoi atomi devono formare legami covalenti finché l'ottetto di valenza non è completato. L'azoto ottiene questo risultato affermandosi come molecole biatomiche NDue, con un triplo legame, N≡N.
Lo stesso accade con il fosforo: due dei suoi atomi di P si legano con un triplo legame per formare la molecola P.Due, P≡P; cioè l'allotropo difosforo. Tuttavia, il fosforo ha una massa atomica maggiore dell'azoto, e i suoi orbitali 3p, più diffusi del 2p dell'azoto, si sovrappongono in modo meno efficiente; pertanto, il PDue esiste solo allo stato gassoso.
A temperatura ambiente invece gli atomi di P preferiscono organizzarsi covalentemente in un altro modo: in una molecola tetraedrica P4:

Si noti che nell'immagine in alto tutti gli atomi di P hanno tre legami singoli invece di un triplo legame. Quindi, il fosforo in P4 completa il suo ottetto di valenza. Tuttavia, nel P4 c'è tensione nei legami P-P, poiché i loro angoli sono lontani da 109,5º a occhio nudo.
- Allotropi
Fosforo bianco
Stessa immagine delle unità P.4 e la sua instabilità spiega perché il fosforo bianco è l'allotropo più instabile di questo elemento.
Unità P4 sono disposti nello spazio per definire un cristallo bcc (fase α) in condizioni normali. Quando la temperatura scende a -77,95 ° C, il cristallo bcc si trasforma in un hcp più denso (presumibilmente) (fase β). Cioè, le unità P4 sono disposti in due strati alternati, A e B, per stabilire una sequenza ABAB ...
Fosforo rosso
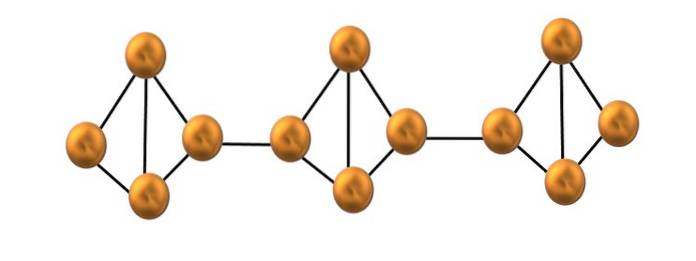
Nell'immagine in alto è mostrato solo un piccolo segmento della struttura del fosforo rosso. Poiché le tre unità sono allineate "simmetricamente", si può dire che si tratta di una struttura cristallina, che si ottiene riscaldando questo fosforo sopra i 250 ºC..
Il fosforo rosso, tuttavia, il più delle volte è costituito da un solido amorfo, quindi la sua struttura è disordinata. Quindi, le catene polimeriche di P4 sarebbero disposti arbitrariamente senza uno schema apparente, alcuni sopra e altri sotto lo stesso piano.
Si noti che questa è la principale differenza strutturale tra fosforo bianco e rosso: nel primo, il P4 sono individuali e nel secondo formano catene. Ciò è possibile perché uno dei legami P-P all'interno del tetraedro è rotto per legarsi al tetraedro vicino. Così, la tensione anulare si riduce e il fosforo rosso acquisisce maggiore stabilità..
Quando c'è una miscela di entrambi gli allotropi, viene offerta all'occhio come un fosforo giallo; una miscela di tetraedri e catene di fosforo amorfo. Il fosforo bianco, infatti, diventa giallastro se esposto ai raggi solari, poiché la radiazione favorisce la rottura del già citato legame P-P..
Fosforo viola o Hittorf
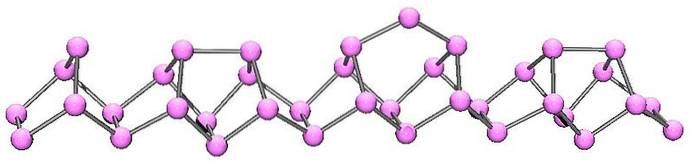
Il fosforo viola è l'evoluzione finale del fosforo rosso. Come si può vedere nell'immagine sopra, è ancora costituito da una catena polimerica; ma ora le strutture sono più complesse. Sembra che l'unità strutturale non sia più la P4 ma il PDue, disposti in modo da formare anelli pentagonali irregolari.
Nonostante l'aspetto asimmetrico della struttura, queste catene polimeriche riescono a disporsi abbastanza bene e con periodicità affinché il fosforo viola stabilisca cristalli monoclinici..
Fosforo nero
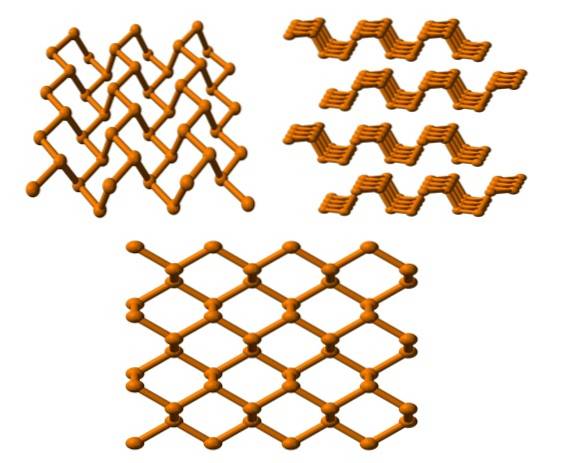
E infine abbiamo l'allotropo del fosforo più stabile: quello nero. Si prepara riscaldando fosforo bianco alla pressione di 12.000 atm.
Nell'immagine in alto (sotto) si può vedere che la sua struttura, da un piano più alto, ha una certa somiglianza con quella della grafite; è una ripida rete di anelli esagonali (anche se sembrano quadrati).
Nell'angolo in alto a sinistra dell'immagine si apprezza meglio quanto appena commentato. I dintorni molecolari degli atomi di P sono piramidi trigonali. Si noti che la struttura vista di lato (angolo in alto a destra), è disposta in strati che si adattano uno sull'altro.
La struttura del fosforo nero è abbastanza simmetrica e ordinata, il che è coerente con la sua capacità di affermarsi come cristalli ortorombici. L'impilamento dei loro strati polimerici rende gli atomi di P non disponibili per molte reazioni chimiche; ed è per questo che è notevolmente stabile e poco reattivo.
Anche se vale la pena menzionare, le forze di dispersione di Londra e le masse molari di questi solidi fosforici sono ciò che governa alcune delle loro proprietà fisiche; mentre le loro strutture e legami P-P definiscono le proprietà chimiche e di altro tipo.
Dove trovare e ottenere
Apatite e fosforite
È il dodicesimo elemento della crosta terrestre e ne rappresenta lo 0,1% in peso. Ci sono circa 550 minerali che contengono fosforo, l'apatite è il minerale più importante per ottenere il fosforo..
L'apatite è un minerale di fosforo e calcio che può contenere quantità variabili di fluoro, cloruro e idrossido, la cui formula è la seguente: [Ca10(PO4)6(F, Cl o OH)Due)]. Oltre all'apatite vi sono altri minerali fosforosi di importanza commerciale; questo è il caso di wavelita e vivianita.
La roccia fosfatica o fosforite è la principale fonte di fosforo. È una roccia sedimentaria non detritica che ha un contenuto di fosforo del 15-20%. Il fosforo è solitamente presente come Ca10(PO4)6FDue (fluoroapatite). È presente anche come idrossiapatite, anche se in misura minore.
Inoltre, la fluoroapatite può essere trovata come parte di rocce ignee e metamorfiche, così come calcare e scisti..
Riduzione elettrotermica della fluoroapatite
Le rocce fosfatiche selezionate vengono trasferite all'impianto di trattamento per la lavorazione. Inizialmente vengono frantumate per ottenere frammenti rocciosi che vengono poi macinati in mulini a palle a 70 giri al minuto.
Quindi, il prodotto della molatura dei frammenti di roccia viene setacciato per poterli frazionare. Quelle frazioni con un contenuto di fosforo del 34% sono scelte come pentossido di fosforo (PDueO5).
Fosforo bianco (P4) è ottenuto industrialmente per riduzione elettrotermica di fluoroapatite con carbonio alla temperatura di 1.500 ºC in presenza di ossido di silicio:
2Ca3(PO4)Due(s) + 6SiODue(s) + 10 C (s) => P4(g) + CaSiO3(l) + CO (g)
Il p4 allo stato gassoso, dopo condensazione, viene raccolto e immagazzinato come un solido bianco immerso in acqua per evitare che reagisca con l'aria esterna.
Leghe
Ramato
La coperta di fosforo è prodotta con diverse percentuali di rame e fosforo: Cu 94% - P 6%; Cu 92% - P 8%; Cu 85% - P 15%, ecc. La lega è utilizzata come disossidante, agente bagnante per l'industria del rame e anche come nucleant nell'industria dell'alluminio.
Broncíneas
Sono leghe di rame, fosforo e stagno che contengono lo 0,5 - 11% di fosforo e lo 0,01 - 0,35% di stagno. Lo stagno aumenta la resistenza alla corrosione, mentre il fosforo aumenta la resistenza all'usura della lega e le conferisce rigidità.
Trova impiego nella fabbricazione di molle, bulloni e, in generale, in articoli che richiedono resistenza alla fatica, all'usura e alla corrosione chimica. Il suo utilizzo è consigliato nelle eliche delle barche.
Placcato nickel
La lega più conosciuta è NiPventi, utilizzo di nichel fosforo nelle leghe per brasatura per migliorarne la resistenza all'erosione chimica, all'ossidazione e alle alte temperature.
La lega è utilizzata nei componenti di turbine a gas e motori a reazione, nella galvanica e nella produzione di elettrodi per saldatura.
Rischi
Il fosforo bianco provoca gravi ustioni cutanee ed è un potente veleno che può essere fatale alla dose di 50 mg. Il fosforo inibisce l'ossidazione cellulare, interferendo con la gestione dell'ossigeno cellulare, che può portare alla degenerazione grassa e alla morte cellulare.
L'avvelenamento acuto da fosforo produce entro i primi quattro giorni dall'ingestione dolore addominale, bruciore, alito odoroso di aglio, vomito fosforescente, sudorazione, crampi muscolari e persino uno stato di shock..
Successivamente, ittero, petecchie, emorragia, coinvolgimento miocardico con aritmie, alterazione del sistema nervoso centrale e morte il decimo giorno dopo l'ingestione..
La manifestazione più evidente dell'avvelenamento cronico da fosforo è il danno alla struttura ossea della mascella.
Un aumento della concentrazione plasmatica di fosforo (iperfosfatemia), di solito si verifica nei pazienti con insufficienza renale. Ciò causa un deposito anormale di fosfati nei tessuti molli, che può portare a disfunzioni vascolari e malattie cardiovascolari..
Applicazioni
Il fosforo è un elemento essenziale per piante e animali. È uno dei tre principali nutrienti delle piante, essendo necessario per la loro crescita e il fabbisogno energetico. Inoltre, fa parte di acidi nucleici, fosfolipidi, prodotti intermedi dei processi metabolici, ecc..
Nei vertebrati, il fosforo è presente nelle ossa e nei denti sotto forma di idrossiapatite..
- Fosforo elementare

Con il fosforo si realizza uno smalto chimico che serve per illuminare le insegne poste sull'alluminio e le sue leghe; così come rame fosforoso e bronzo.
Viene anche usato per fabbricare bombe incendiarie, granate, fumogeni e proiettili traccianti. Il fosforo rosso viene utilizzato per creare fiammiferi o fiammiferi di sicurezza.
Il fosforo bianco viene utilizzato per produrre organofosfati. Inoltre, è utilizzato nella produzione di acido fosforico.
Una grande quantità del fosforo prodotto viene incenerito per la produzione di tetraossido di fosforo (P4O10), ottenuto come polvere o solido.
- Composti
Fosfina
È la materia prima per la produzione di vari composti del fosforo. Agisce come agente dopante per componenti elettronici.
Acido fosforico
Viene utilizzato nella produzione di bibite analcoliche per il caratteristico sapore che conferisce loro. Agisce sulle rocce fosfatiche per formare fosfato diidrogeno calcio [Ca (H.DuePO4)Due], noto anche come superfosfato, che viene utilizzato come fertilizzante.
L'acido fosforico è un elemento condizionante dello smalto dei denti per facilitare l'adesione dei materiali da restauro. Viene anche utilizzato, miscelato con olio, urea, catrame, bitume e sabbia, per formare asfalto; materiale utilizzato nella riparazione delle vie di comunicazione terrestre.
Organofosfati
I composti organofosfati hanno numerose applicazioni; come: ritardanti di fiamma, pesticidi, agenti di estrazione, agenti ad azione nervosa e per il trattamento delle acque.
Diidrogeno calcio fosfato diidrato
È usato come fertilizzante, lievito in polvere, additivo per l'alimentazione animale e nella produzione di dentifrici.
Anidride fosforica
Viene utilizzato nelle analisi chimiche come agente disidratante e nella sintesi organica come agente condensante. Il composto è destinato principalmente alla produzione di acido ortofosforico.
Tripolifosfato di sodio
Utilizzato nei detergenti e come addolcitore d'acqua, migliora l'azione dei detergenti e aiuta a prevenire la corrosione dei tubi.
Fosfato di sodio
Utilizzato come detergente e addolcitore d'acqua.
Fosfati di sodio
Fosfato di sodio bibasico (NaDueHPO4) e fosfato di sodio monobasico (NaHDuePO4) sono i componenti di un sistema tampone di pH, che agisce anche sugli esseri viventi; compresi gli esseri umani.
Riferimenti
- Reid Danielle. (2019). Allotropi del fosforo: forme, usi ed esempi. Studia. Estratto da: study.com
- Prof. Robert J. Lancashire. (2014). Lezione 5c. Struttura degli elementi, continua P, S e I. Estratto da: chem.uwimona.edu.jm
- BYJU'S. (2019). Fosforo rosso. Estratto da: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang, et al. (2019). Proprietà strutturali ed ottiche elettroniche del fosforo blu multistrato: uno studio sui primi principi. Journal of Nanomaterials, vol. 2019, ID articolo 4020762, 8 pagine. doi.org/10.1155/2019/4020762
- Dottor Dough Stewar. (2019). Fatti dell'elemento fosforo. Chemicool. Estratto da: chemicool.com
- Wikipedia. (2019). Fosforo. Estratto da: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (03 luglio 2019). Fatti sul fosforo (numero atomico 15 o simbolo dell'elemento P). Estratto da: thoughtco.com
- Linus Pauling Institute. (2019). Fosforo. Recupero da: lpi.oregonstate.edu
- Bernardo Fajardo P. & Héctor Lozano V. (s.f.). Elaborazione di rocce fosfatiche nazionali per la produzione di perfosfato. [PDF]. Estratto da: bdigital.unal.edu.co
- The Editors of Encyclopaedia Britannica. (16 novembre 2018). Elemento chimico del fosforo. Encyclopædia Britannica. Estratto da: britannica.com
- Reade International Corp. (2018). Lega di rame fosforo (CuP). Estratto da: reade.com
- KBM Affilips. (27 dicembre 2018). Lega madre di nichel fosforo (NiP). AZoM. Recupero da: azom.com
- Lenntech B.V. (2019). Tavola periodica: fosforo. Estratto da: lenntech.com
- Abhijit Naik. (2018, 21 febbraio). Usi del fosforo. Estratto da: sciencestruck.com


Nessun utente ha ancora commentato questo articolo.