
Storia, proprietà, struttura, ottenimento, rischi, usi del fluoro
Il fluoro È un elemento chimico che è rappresentato dal simbolo F e dal gruppo di teste 17, a cui appartengono gli alogeni. Si distingue sopra gli altri elementi della tavola periodica, per essere il più reattivo ed elettronegativo; reagisce con quasi tutti gli atomi, quindi forma innumerevoli sali e composti organofluorurati.
In condizioni normali è un gas giallo pallido, che può essere confuso con il verde giallastro. Allo stato liquido, mostrato nell'immagine sotto, il suo colore giallo si intensifica un po 'di più, che scompare completamente quando si solidifica al punto di congelamento..

Tale è la sua reattività, nonostante la natura volatile del suo gas, che rimane intrappolato nella crosta terrestre; soprattutto sotto forma del minerale fluorite, noto per i suoi cristalli viola. Allo stesso modo, la sua reattività lo rende una sostanza potenzialmente pericolosa; reagisce vigorosamente a tutto ciò che tocca e brucia in fiamme.
Tuttavia, molti dei suoi sottoprodotti possono essere innocui e persino utili, a seconda delle loro applicazioni. Ad esempio, l'uso più diffuso del fluoro, aggiunto nella sua forma ionica o minerale (come i sali di fluoro), è la preparazione di dentifrici al fluoro, che aiutano a proteggere lo smalto dei denti..
Il fluoro ha la particolarità di poter stabilizzare i numeri elevati o gli stati di ossidazione di molti altri elementi. Maggiore è il numero di atomi di fluoro, più reattivo è il composto (a meno che non sia un polimero). Allo stesso modo, aumenteranno i suoi effetti con le matrici molecolari; per il meglio o il peggio.
Indice articolo
- 1 Storia
- 1.1 Uso della fluorite
- 1.2 Preparazione dell'acido fluoridrico
- 1.3 Isolamento
- 1.4 Interesse per il fluoro
- 2 Proprietà fisiche e chimiche
- 2.1 Aspetto
- 2.2 Numero atomico (Z)
- 2.3 Peso atomico
- 2.4 Punto di fusione
- 2.5 Punto di ebollizione
- 2.6 Densità
- 2.7 Calore di vaporizzazione
- 2.8 Capacità termica molare
- 2.9 Pressione di vapore
- 2.10 Conduttività termica
- 2.11 Ordine magnetico
- 2.12 Odore
- 2.13 numeri di ossidazione
- 2.14 Energia di ionizzazione
- 2.15 Elettronegatività
- 2.16 Agente ossidante
- 2.17 Reattività
- 3 Struttura e configurazione elettronica
- 3.1 Molecola biatomica
- 3.2 Liquido e solido
- 4 Dove trovare e ottenere
- 4.1 Lavorazione della fluorite
- 4.2 Elettrolisi del fluoruro di idrogeno
- 5 isotopi
- 6 Ruolo biologico
- 7 Rischi
- 7.1 Fluorosi dentale
- 7.2 Fluorosi scheletrica
- 8 Usi
- 8.1 Dentifrici
- 8.2 Fluorizzazione dell'acqua
- 8.3 Agente ossidante
- 8.4 Polimeri
- 8.5 Farmacisti
- 8.6 Incisione su vetro
- 8.7 Arricchimento dell'uranio
- 9 Riferimenti
Storia
Uso della fluorite
Nel 1530, il mineralogista tedesco Georgius Agricola scoprì che il minerale fluorescente poteva essere utilizzato nella purificazione dei metalli. Fluorspar è un altro nome per fluorite, un minerale fluoro costituito da fluoruro di calcio (CaFDue).
L'elemento fluoro non era stato scoperto da allora e il "fluoir" nella fluorite veniva dalla parola latina "fluere" che significa "fluire"; poiché questo era esattamente ciò che la fluorite o la fluorite facevano con i metalli: li aiutava a lasciare il campione.
Preparazione dell'acido fluoridrico
Nel 1764, Andreas Sigismud Margraff riuscì a preparare l'acido fluoridrico, riscaldando la fluorite con acido solforico. Le storte di vetro sono state fuse dall'azione dell'acido, quindi il vetro è stato sostituito da metalli.
Viene anche attribuita a Carl Scheele, nel 1771, la preparazione dell'acido con lo stesso metodo seguito da Margraff. Nel 1809, lo scienziato francese Andre-Marie Ampere propose che l'acido fluorico o fluoridrico fosse un composto costituito da idrogeno e un nuovo elemento simile al cloro..
Gli scienziati hanno cercato a lungo di isolare il fluoruro utilizzando acido fluoridrico; ma la sua pericolosità rendeva difficile il progresso in questo senso.
Humphry Davy, Joseph Louis Gay-Lussac e Jacques Thénard hanno avuto forti dolori quando hanno inalato acido fluoridrico (acido fluoridrico senz'acqua e in forma gassosa). Gli scienziati Paulin Louyet e Jerome Nickles sono morti per avvelenamento in circostanze simili.
Edmond Frémy, un ricercatore francese, ha cercato di creare acido fluoridrico secco per evitare la tossicità del fluoruro di idrogeno acidificando il bifluoruro di potassio (KHFDue), ma durante l'elettrolisi non c'era conduzione della corrente elettrica.
Solitudine
Nel 1860, il chimico inglese George Gore tentò l'elettrolisi dell'acido fluoridrico secco e riuscì a isolare una piccola quantità di fluoro gassoso. Tuttavia, si è verificata un'esplosione quando idrogeno e fluoro si sono ricombinati violentemente. Gore ha attribuito l'esplosione a una perdita di ossigeno..
Nel 1886, il chimico francese Henri Moisson riuscì per la prima volta a isolare il fluoro. In precedenza, il lavoro di Moisson è stato interrotto quattro volte da un grave avvelenamento da fluoruro di idrogeno, durante il tentativo di isolare l'elemento..
Moisson era uno studente di Frémy e ha fatto affidamento sui suoi esperimenti per isolare il fluoro. Moisson ha utilizzato una miscela di fluoruro di potassio e acido fluoridrico nell'elettrolisi. La soluzione risultante conduceva elettricità e fluoro gassoso raccolti all'anodo; cioè all'elettrodo caricato positivamente.
Moisson utilizzava apparecchiature resistenti alla corrosione, in cui gli elettrodi erano fatti di una lega di platino e iridio. Nell'elettrolisi, ha usato un contenitore di platino e ha raffreddato la soluzione elettrolitica a una temperatura di -23ºF (-31ºC)..
Infine, il 26 giugno 1886, Henri Moissson riuscì a isolare il fluoro, opera che gli consentì di vincere il Premio Nobel nel 1906.
Interesse per il fluoro
L'interesse per la ricerca sul fluoruro è stato perso per un po '. Tuttavia, lo sviluppo del Progetto Manhattan per la produzione della bomba atomica, lo ha nuovamente potenziato.
L'azienda americana Dupont ha sviluppato, tra gli anni 1930 e 1940, prodotti fluorurati come i clorofluorocarburi (Freon-12), utilizzati come refrigeranti; e plastica politetrafluoroetilene, meglio conosciuta con il nome Teflon. Ciò ha prodotto un aumento della produzione e del consumo di fluoro..
Nel 1986, in una conferenza a circa un secolo dall'isolamento del fluoro, il chimico americano Karl O. Christe presentò un metodo chimico per la preparazione del fluoro mediante la reazione tra KDueMnF6 e l'SbF5.
Proprietà fisiche e chimiche
Aspetto
Il fluoro è un gas giallo pallido. Allo stato liquido è di colore giallo brillante. Nel frattempo, il solido può essere opaco (alfa) o trasparente (beta).
Numero atomico (Z)
9.
Peso atomico
18.998 u.
Punto di fusione
-219,67 ºC.
Punto di ebollizione
-188,11 ºC.
Densità
A temperatura ambiente: 1,696 g / L.
Al punto di fusione (liquido): 1,505 g / mL.
Calore di vaporizzazione
6,51 kJ / mol.
Capacità termica molare
31 J / (mol K).
Pressione del vapore
Alla temperatura di 58 K ha una tensione di vapore di 986,92 atm.
Conduttività termica
0,0277 W / (m · K)
Ordine magnetico
Diamagnetico
Odore
Caratteristico odore pungente e pungente, rilevabile anche a 20 ppb.
Numeri di ossidazione
-1, che corrisponde all'anione fluoruro, F-.
Energia ionizzata
-Primo: 1.681 kJ / mol
-Secondo: 3.374 kJ / mol
-Terzo: 6.147 KJ / mol
Elettronegatività
3.98 della scala Pauling.
È l'elemento chimico con le più alte elettronegatività; cioè ha un'alta affinità per gli elettroni degli atomi con cui si lega. Per questo motivo, gli atomi di fluoro generano grandi momenti di dipolo in regioni specifiche di una molecola..
La sua elettronegatività ha anche un altro effetto: gli atomi ad essa legati perdono così tanta densità elettronica che iniziano ad acquisire una carica positiva; questo è un numero di ossidazione positivo. Più atomi di fluoro ci sono in un composto, l'atomo centrale avrà un numero di ossidazione più positivo..
Ad esempio, in OFDue l'ossigeno ha un numero di ossidazione di +2 (ODue+FDue-); nell'UF6, L'uranio ha un numero di ossidazione di +6 (U6+F6-); lo stesso accade con lo zolfo in SF6 (S6+F6-); e infine c'è l'AgFDue, dove l'argento ha anche un numero di ossidazione di +2, raro per esso.
Pertanto, gli elementi riescono a partecipare con i loro numeri di ossidazione più positivi quando formano composti con fluoro..
Agente ossidante
Il fluoro è l'elemento ossidante più potente, quindi nessuna sostanza è in grado di ossidarlo; e per questo motivo non si trova libero in natura.
Reattività
Il fluoro è in grado di combinarsi con tutti gli altri elementi eccetto elio, neon e argon. Inoltre non attacca l'acciaio dolce o il rame a temperature normali. Reagisce violentemente con materiali organici come gomma, legno e tessuto.
Il fluoro può reagire con il gas nobile xeno per formare il forte difluoruro di xeno ossidante, XeFDue. Inoltre reagisce con l'idrogeno per formare un alogenuro, acido fluoridrico, HF. A sua volta, l'acido fluoridrico si dissolve in acqua per produrre il famoso acido fluoridrico (come il vetro).
L'acidità degli acidi acidi, classificata in ordine crescente è:
HF < HCl < HBr < HI
L'acido nitrico reagisce con il fluoro per formare nitrato di fluoro, FNO3. Nel frattempo, l'acido cloridrico reagisce vigorosamente con il fluoro per formare HF, OFDue e ClF3.
Struttura e configurazione elettronica

Molecola biatomica

L'atomo di fluoro nel suo stato fondamentale ha sette elettroni di valenza, che si trovano negli orbitali 2s e 2p secondo la configurazione elettronica:
[He] 2sDue 2 P5
La teoria del legame di valenza (VTE) afferma che due atomi di fluoro, F, sono legati in modo covalente a ciascuno completo del suo ottetto di valenza.
Ciò avviene rapidamente perché basta un solo elettrone per diventare isoelettronico al gas nobile neon; ei suoi atomi sono molto piccoli, con una carica nucleare efficace molto forte che richiede facilmente elettroni dall'ambiente.
La molecola FDue (immagine in alto), ha un unico legame covalente, F-F. Nonostante la sua stabilità rispetto agli atomi F liberi, è una molecola altamente reattiva; omonucleare, apolare e desideroso di elettroni. Ecco perché il fluoro, come FDue, è una specie molto tossica e pericolosa.
Perché la FDue è apolare, le sue interazioni dipendono dalla sua massa molecolare e dalle forze di diffusione di Londra. Ad un certo punto, la nuvola elettronica attorno a entrambi gli atomi di F deve deformarsi e originare un dipolo istantaneo che ne induce un altro in una molecola vicina; in modo che si attraggano lentamente e debolmente.
Liquido e solido
La molecola FDue è molto piccolo e si diffonde nello spazio in tempi relativamente brevi. Nella sua fase gassosa presenta un colore giallo paglierino (che può essere scambiato per un verde lime). Quando la temperatura scende a -188 ºC, le forze di dispersione diventano più efficaci e formano le molecole F.Due fondersi abbastanza per definire un liquido.
Il fluoro liquido (prima immagine) sembra ancora più giallo del suo rispettivo gas. In esso, le molecole FDue sono più vicini e interagiscono con la luce in misura maggiore. È interessante notare che, una volta che il cristallo cubico di fluoro distorto si forma a -220 ° C, il colore svanisce e rimane come un solido trasparente..
Ora che le molecole F.Due sono così vicini (ma senza che le loro rotazioni molecolari si fermino), sembra che i loro elettroni acquisiscano una certa stabilità e, quindi, il loro salto elettronico è troppo grande perché la luce possa interagire anche con il cristallo.
Fasi cristalline
Questo cristallo cubico corrisponde alla fase β (non è un allotropo perché è sempre lo stesso FDue). Quando la temperatura scende ulteriormente, fino a -228 ºC, il fluoro solido subisce una transizione di fase; il cristallo cubico diventa monoclino, la fase α:
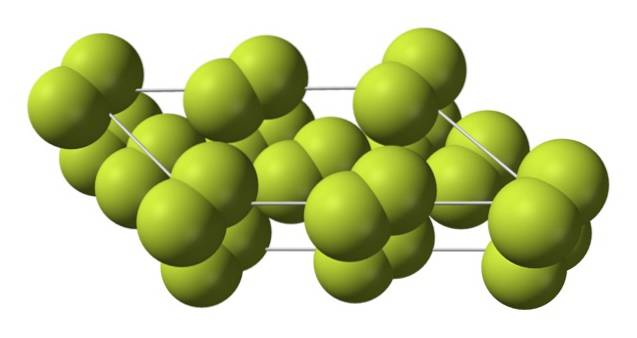
A differenza di β-FDue, l'α-FDue è opaco e duro. Forse è perché le molecole F.Due non hanno più così tanta libertà di ruotare nelle loro posizioni fisse su cristalli monoclinici; dove interagiscono in misura maggiore con la luce, ma senza eccitare i loro elettroni (il che spiegherebbe superficialmente la loro opacità).
La struttura cristallina di α-FDue era difficile da studiare con i metodi convenzionali di diffrazione dei raggi X. Questo perché la transizione dalla fase β alla fase α è altamente esotermica; quindi il cristallo è praticamente esploso, nello stesso momento in cui ha avuto poca interazione con la radiazione.
Ci sono voluti circa cinquant'anni prima che gli scienziati tedeschi (Florian Kraus et al.) Decifrassero completamente la struttura di α-FDue più precisamente grazie alle tecniche di diffrazione dei neutroni.
Dove trovare e ottenere
Il fluoro è al 24 ° posto tra gli elementi più comuni nell'universo. Tuttavia, sulla Terra è massa 13vo elemento, con una concentrazione di 950 ppm nella crosta terrestre e una concentrazione di 1,3 ppm nell'acqua di mare.
I terreni hanno una concentrazione di fluoro compresa tra 150 e 400 ppm e in alcuni terreni la concentrazione può raggiungere 1.000 ppm. Nell'aria atmosferica è presente in una concentrazione di 0,6 ppb; ma è stato registrato in alcune città fino a 50 ppb.
Il fluoro è ottenuto principalmente da tre minerali: fluorite o fluorospar (CaFDue), fluoroapatite [Ca5(PO4)3F] e criolite (Na3AlF6).
Elaborazione della fluorite
Dopo aver raccolto le rocce con il minerale fluorite, vengono sottoposte ad una frantumazione primaria e secondaria. Con la frantumazione secondaria si ottengono frammenti di roccia molto piccoli.
I frammenti di roccia vengono quindi portati in un mulino a palle per la riduzione in polvere. Acqua e reagenti vengono aggiunti per formare una pasta, che viene posta in una vasca di galleggiamento. L'aria viene iniettata sotto pressione per formare bolle e quindi la fluorite finisce per galleggiare sulla superficie acquosa.
Silicati e carbonati si depositano mentre la fluorite viene raccolta e portata ai forni di essiccazione..
Una volta ottenuta la fluorite, viene fatta reagire con acido solforico per produrre acido fluoridrico:
CaFDue + HDueSW4 => 2 HF + CaSO4
Elettrolisi del fluoruro di idrogeno
Nella produzione del fluoro viene seguito il metodo utilizzato da Moisson nel 1886, con alcune modifiche..
Un'elettrolisi è costituita da una miscela di fluoruro di potassio fuso e acido fluoridrico, con un rapporto molare da 1: 2,0 a 1: 2,2. La temperatura del sale fuso è di 70 - 130 ºC.
Il catodo è costituito da una lega o acciaio Monel e l'anodo è carbonio degrafito. Il processo di produzione del fluoro durante l'elettrolisi può essere descritto come segue:
2HF => HDue + FDue
L'acqua viene utilizzata per raffreddare la camera di elettrolisi, ma la temperatura deve essere superiore al punto di fusione dell'elettrolita per evitare la solidificazione. L'idrogeno prodotto nell'elettrolisi viene raccolto al catodo, mentre il fluoro all'anodo.
Isotopi
Il fluoro ha 18 isotopi, essendo il 19F l'unico isotopo stabile con il 100% di abbondanza. Il 18F ha un'emivita di 109,77 minuti ed è l'isotopo radioattivo del fluoro con l'emivita più lunga. Il 18F è usato come fonte di positroni.
Ruolo biologico
Non è nota l'attività metabolica del fluoro nei mammiferi o nelle piante superiori. Tuttavia, alcune piante e spugne marine sintetizzano il monofluoroacetato, un composto velenoso, che usano come protezione per prevenirne la distruzione.
Rischi
Un consumo eccessivo di fluoro è stato associato alla fluorosi ossea negli adulti e alla fluorosi dentale nei bambini, nonché ad alterazioni della funzione renale. Per questo motivo, il servizio sanitario pubblico degli Stati Uniti (PHS) ha suggerito che la concentrazione di fluoruro nell'acqua potabile non dovrebbe essere superiore a 0,7 mg / L.
Nel frattempo, la US Enviromental Protection Agency (EPA) ha stabilito che la concentrazione di fluoro nell'acqua potabile non dovrebbe essere superiore a 4 mg / L, al fine di evitare la fluorosi scheletrica, in cui il fluoruro si accumula nelle ossa. Questo può portare all'indebolimento dell'osso e alle fratture..
Il fluoro è stato associato a danni alla ghiandola paratiroidea, con una diminuzione del calcio nelle strutture ossee e alte concentrazioni di calcio nel plasma.
Tra le alterazioni attribuite all'eccesso di fluoro ci sono le seguenti: fluorosi dentale, fluorosi scheletrica e danno alla ghiandola paratiroidea.
Fluorosi dentale
La fluorosi dentale si manifesta con piccole striature o macchie nello smalto dei denti. I bambini di età inferiore ai 6 anni non dovrebbero usare collutori contenenti fluoro..
Fluorosi scheletrica
Nella fluorosi scheletrica possono essere diagnosticati dolore e danni alle ossa e alle articolazioni. L'osso può indurirsi e perdere elasticità, aumentando il rischio di fratture.
Applicazioni
Dentifricio

Iniziamo con la sezione sugli usi del fluoro con quello più noto: quello di servire come componente di molti dentifrici. Questo non è l'unico utilizzo in cui si apprezza il contrasto tra la sua molecola F.Due, estremamente velenoso e pericoloso, e l'anione F-, che a seconda del tuo ambiente può essere utile (anche se a volte no).
Quando mangiamo cibo, soprattutto dolci, i batteri lo scompongono aumentando l'acidità della nostra saliva. Poi arriva un punto in cui il pH è abbastanza acido da degradare e demineralizzare lo smalto dei denti; l'idrossiapatite si rompe.
Tuttavia, in questo processo gli ioni F- interagire con CaDue+ formare una matrice di fluorapatite; più stabile e durevole dell'idrossiapatite. O almeno, questo è il meccanismo proposto per spiegare l'azione dell'anione fluoruro sui denti. È probabile che sia più complesso e abbia un equilibrio idrossiapatite-fluorapatite dipendente dal pH.
Questi anioni F- Sono disponibili negli impianti dentali sotto forma di sali; come: NaF, SnFDue (il famoso fluoruro stannoso) e NaPOF. Tuttavia, la concentrazione di F- Deve essere basso (meno dello 0,2%), poiché altrimenti provoca effetti negativi sul corpo.
Fluorizzazione dell'acqua
Proprio come il dentifricio, i sali di fluoro sono stati aggiunti alle fonti di acqua potabile per combattere la carie in chi lo beve. La concentrazione dovrebbe essere ancora molto più bassa (0,7 ppm). Tuttavia, questa pratica è spesso oggetto di diffidenza e controversia, in quanto le sono stati attribuiti possibili effetti cancerogeni.
Agente ossidante
Gas FDue si comporta come un agente ossidante molto forte. Questo fa sì che molti composti brucino più velocemente rispetto a quando vengono esposti all'ossigeno e a una fonte di calore. Questo è il motivo per cui è stato utilizzato nelle miscele di carburante per missili, in cui può persino sostituire l'ozono.
Polimeri
In molti usi i contributi di fluoro non sono dovuti alla FDue o F-, ma direttamente ai suoi atomi elettronegativi come parte di un composto organico. In sostanza, parliamo di un collegamento C-F..
A seconda della struttura, i polimeri o le fibre con legami C-F sono generalmente idrofobici, quindi non si bagnano né resistono all'attacco dell'acido fluoridrico; O meglio ancora, possono essere ottimi isolanti elettrici e materiali utili con cui vengono realizzati oggetti come tubi e guarnizioni. Teflon e nafion sono esempi di questi polimeri fluorurati.
Farmacisti
La reattività del fluoro rende discutibile il suo utilizzo per la sintesi di più composti del fluoro, organici o inorganici. Nei prodotti organici, in particolare quelli con effetti farmacologici, la sostituzione di uno dei loro eteroatomi con atomi di F aumenta (positivamente o negativamente) la loro azione sul bersaglio biologico..
Ecco perché nell'industria farmaceutica la modifica di alcuni farmaci mediante l'aggiunta di atomi di fluoro è sempre sul tavolo..
Molto simile accade con erbicidi e fungicidi. Il fluoro in essi contenuto può aumentare la loro azione ed efficacia su insetti e parassiti fungini..
Incisione su vetro
L'acido fluoridrico, per la sua aggressività con il vetro e la ceramica, è stato utilizzato per incidere pezzi sottili e delicati di questi materiali; solitamente destinati alla fabbricazione di microcomponenti di computer o lampadine elettriche.
Arricchimento dell'uranio
Uno degli usi più rilevanti del fluoro elementare è quello di aiutare ad arricchire l'uranio come 235U. Per questo, i minerali di uranio vengono sciolti in acido fluoridrico, producendo UF4. Questo fluoruro inorganico reagisce quindi con la FDue, per trasformarsi così in UF6 (235PHEW6 Y 238PHEW6).
Successivamente, e mediante centrifugazione a gas, il 235PHEW6 separa da 238PHEW6 per essere successivamente ossidato e immagazzinato come combustibile nucleare.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Krämer Katrina. (2019). La struttura del fluoro congelato rivisitata dopo 50 anni. La Royal Society of Chemistry. Estratto da: chemistryworld.com
- Wikipedia. (2019). Fluoro. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Fluoro. Database PubChem. CID = 24524. Estratto da: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fatti dell'elemento fluoro. Chemicool. Estratto da: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21 febbraio). Gli usi sorprendentemente comuni del fluoro altamente reattivo. Estratto da: sciencestruck.com
- Paola Opazo Sáez. (4 febbraio 2019). Fluoro nel dentifricio: fa bene o fa male alla salute? Estratto da: nacionfarma.com
- Karl Christe e Stefan Schneider. (8 maggio 2019). Fluoro: elemento chimico. Encyclopædia Britannica. Estratto da: britannica.com
- Lenntech B.V. (2019). Tavola periodica: ossigeno. Estratto da: lenntech.com
- Gagnon Steve. (s.f.). L'elemento fluoro. Jefferson Lab. Estratto da: education.jlab.org
- Il team di contenuti medici ed editoriali dell'American Cancer Society. (2015, 28 luglio). Fluorizzazione dell'acqua e rischio di cancro. Estratto da: cancer.org



Nessun utente ha ancora commentato questo articolo.