
Proprietà, rischi e usi del ferrocianuro di potassio
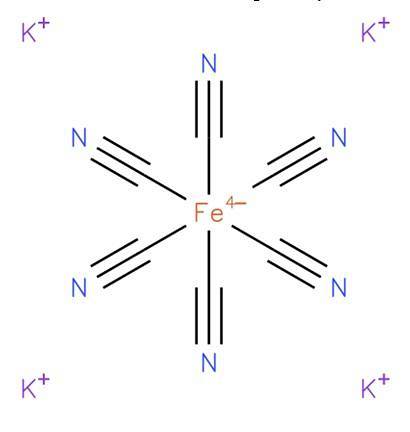
Il ferrocianuro di potassio, noto anche come esacianoferrato di potassio (II) o giallo di Prussia, è un composto inorganico di formula K4[Fede (CN)6]. È un sale di potassio del complesso di coordinazione dei ferrocianuri (Fe (CN)64-) ed è generalmente nella forma triidrata K4[Fede (CN)6] · HDueO. La sua struttura è mostrata nella figura 1 (EMBL-EBI, 2008).
Storicamente, era prodotto da fonti di anidride carbonica di origine biologica, limatura di ferro e carbonato di potassio. Fonti comuni di azoto e carbonio erano scarti di cuoio, frattaglie o sangue essiccato.
Attualmente il ferrocianuro di potassio è prodotto industrialmente da acido cianidrico, cloruro ferroso e idrossido di calcio, la cui combinazione dà CaDue [Fede (CN) 6] · 11HDueO.
Questa soluzione viene quindi trattata con sali di potassio per far precipitare il sale CaK misto calcio-potassio.Due [Fede (CN) 6], che a sua volta viene trattato con carbonato di potassio per dare il sale tetrapotassico.
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Reattività e pericoli
- 2.1 Contatto con gli occhi
- 2.2 Contatto con la pelle
- 2.3 Inalazione
- 2.4 Ingestione
- 3 usi
- 3.1 1- Industria alimentare
- 3.2 2- Industria mineraria e metallurgica
- 3.3 3- Reagente da laboratorio
- 4 Riferimenti
Proprietà fisiche e chimiche
Il ferrocianuro di potassio è un cristallo monoclino di colore giallo o giallo pallido, a seconda del livello di idratazione, senza un aroma caratteristico (National Center for Biotechnology Information., 2017). Il suo aspetto è mostrato nella figura 2 (Ferrocianuro di potassio, 2017).

Il composto ha un peso molecolare di 368,35 g / mol per la forma anidra e 422,388 g / mol per la forma triidrata. Ha una densità di 1,85 g / ml e un punto di fusione di 70 ° C dove inizia a decomporsi (Royal Society of Chemistry, 2015).
Il composto è solubile in acqua, essendo in grado di sciogliere 28,9 grammi di composto in 100 ml di questo solvente. È insolubile in etere dietilico, etanolo e toluene. Il composto reagisce al calore per formare cianuro di potassio secondo la reazione:
K4[Fede (CN)6] → 4 KCN + FeCDue + NDue
In combinazione con acidi concentrati, forma acido cianidrico (HCN) che è un gas altamente velenoso e infiammabile e può formare miscele esplosive nell'aria (Laffort, 2001).
Reattività e rischi
Il ferrocianuro di potassio è un composto stabile, incompatibile con acidi forti e agenti ossidanti. Il ferrocianuro di potassio non è tossico e non si scompone in cianuro nel corpo. La tossicità nei ratti è bassa, con una dose letale (LD50) a 6400 mg / kg.
La sostanza è tossica per i polmoni e le mucose. Il composto può causare irritazione in caso di contatto con la pelle e gli occhi..
Se ingerito può causare irritazione al tratto gastrointestinale e in caso di inalazione provoca irritazione della mucosa nasale e dell'apparato respiratorio..
Il contatto con gli occhi può provocare danni alla cornea o cecità. Il contatto con la pelle può causare infiammazioni e vesciche.
L'inalazione di polvere provoca irritazione del tratto gastrointestinale o respiratorio, caratterizzata da bruciore, starnuti e tosse. Una grave sovraesposizione può causare danni ai polmoni, soffocamento, perdita di coscienza o morte..
Contatto visivo
In caso di contatto con gli occhi, le lenti a contatto devono essere controllate e rimosse. Sciacquare immediatamente gli occhi con abbondante acqua fredda per almeno 15 minuti.
Contatto con la pelle
L'area interessata deve essere risciacquata immediatamente con abbondante acqua per almeno 15 minuti mentre si rimuovono gli indumenti e le scarpe contaminati. Copri la pelle irritata con un emolliente.
Lavare indumenti e scarpe prima di riutilizzarli. Se il contatto è grave, lavare con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica.
Inalazione
La vittima dovrebbe essere spostata in un luogo fresco. Se non respira, deve essere praticata la respirazione artificiale. Se la respirazione è difficile, somministrare ossigeno.
Ingestione
Se il composto viene ingerito, il vomito non deve essere indotto se non indicato dal personale medico. Allenta gli indumenti stretti come il colletto della camicia, la cintura o la cravatta.
In tutti i casi, è necessario ottenere immediatamente assistenza medica (Scheda di dati di sicurezza del materiale Potassium ferrocyanide trihydrate, 2013).
Applicazioni
1- Industria alimentare
Il giallo di Prussia è anche noto per il numero di additivo alimentare europeo approvato: E536 e ha vari usi nell'industria alimentare. È usato come antiagglomerante sia per il sale stradale che per il sale da cucina.
Ha anche un uso enologico per rimuovere rame e ferro in vinificazione. Il rame è usato come fungicida nell'uva (Università di Wageningen, 2014).
Viene anche utilizzato per la fermentazione dell'acido citrico (D. S. Clark, 1965). Il ferrocianuro di potassio può essere utilizzato anche come fertilizzante per le piante.
2- Industria mineraria e metallurgica
Il ferrocianuro di potassio viene utilizzato per rimuovere il rame dai minerali di molibdeno. Viene anche utilizzato per la cementazione dell'acciaio (ferrocianuro di potassio, K4Fe (CN) 6, 2012).
La cementazione è un trattamento termochimico applicato alle parti in acciaio. Il processo porta il carbonio in superficie per diffusione, che viene impregnato modificandone la composizione.
3- Reagente da laboratorio
Il ferrocianuro di potassio viene utilizzato per determinare la concentrazione di permanganato di potassio, un composto spesso utilizzato nelle titolazioni basate su reazioni redox..
Il ferrocianuro di potassio viene utilizzato in una miscela con ferricianuro di potassio e soluzione tamponata con fosfato per fornire un tampone per la beta-galattosidasi, che viene utilizzato per scindere X-Gal (5-bromo-4-cloro-3-indolil-β -D- galattopiranoside, dando una visualizzazione blu brillante dove un anticorpo (o altra molecola), coniugato a Beta-gal, si è legato al suo bersaglio.
Il composto viene utilizzato anche per la produzione del blu di Prussia. Quando reagisce con Fe (III) dà un colore blu di Prussia, motivo per cui viene utilizzato come reagente di identificazione per il ferro nei laboratori..
Viene anche utilizzato per la determinazione dello zinco in campioni di solfuro di zinco. Il campione viene sciolto in HCl 6N e far bollire sotto cappa per rimuovere l'idrogeno solforato, neutralizzare con idrossido di ammonio e aggiungere 3 gocce di HCl.
Portare a ebollizione e aggiungere 5 ml di soluzione 1N di ferrocianuro di potassio. La presenza di un precipitato di ferrocianuro di zinco bianco indica un test positivo per questo elemento (Mehlig, 1927).
Riferimenti
- S. Clark, K. I. (1965). Effetto del ferrocianuro di potassio sulla composizione chimica del mosto di melassa utilizzato nella fermentazione dell'acido citrico. Biotecnologia e bioingegneria Volume 7, Numero 2, 269-278. Recupero da onlinelibrary.wiley.com.
- EMBL-EBI. (2008, 16 gennaio). esacianoferrato di potassio (4−). Recupero da ebi.ac.uk.
- (2001, 5 marzo). FERROCIANURA DI POTASSIO. Recuperato da laffort.com.
- Scheda di sicurezza del materiale Ferrocianuro di potassio triidrato. (2013, 21 maggio). Recupero da sciencelab.com.
- Mehlig, J. P. (1927). Uso del ferrocianuro di potassio come test di conferma per lo zinco. Chem. Educ. 4 (6), 722. Recuperato da pubs.acs.org.
- National Center for Biotechnology Information ... (2017, 15 aprile). Database composto di PubChem; CID = 161067. Recupero da pubchem.ncbi.nlm.nih.gov.
- Ferrocianuro di potassio. (2017, 25 marzo). Recupero da sciencemadness.org.
- Ferrocianuro di potassio, K4Fe (CN) 6. (2012). Recuperato da atomistry.com.
- Royal Society of Chemistry. (2015). ferrocianuro di potassio. Recupero da chemspider.com.
- Università di Wageningen. (2014, 14 agosto). E536: ferrocianuro di potassio. Recuperato da food-info.net.


Nessun utente ha ancora commentato questo articolo.