
Caratteristiche e tipologie dei legami interatomici

Il collegamento interatomico È il legame chimico che si forma tra gli atomi per produrre molecole. Anche se oggi gli scienziati generalmente concordano sul fatto che gli elettroni non ruotano attorno al nucleo, nel corso della storia si è pensato che ogni elettrone orbitasse attorno al nucleo di un atomo in un guscio separato..
Oggi gli scienziati hanno concluso che gli elettroni si librano su aree specifiche dell'atomo e non formano orbite, tuttavia il guscio di valenza è ancora utilizzato per descrivere la disponibilità di elettroni..
Linus Pauling ha contribuito alla moderna comprensione del legame chimico scrivendo il libro "The Nature of Chemical Bonding" dove ha raccolto idee da Sir Isaac Newton, Étienne François Geoffroy, Edward Frankland e in particolare Gilbert N. Lewis.
In esso, ha collegato la fisica della meccanica quantistica con la natura chimica delle interazioni elettroniche che si verificano quando si creano legami chimici..
Il lavoro di Pauling si è concentrato sullo stabilire che i veri legami ionici e covalenti si trovano alle estremità di uno spettro di legami e che la maggior parte dei legami chimici sono classificati tra questi estremi..
Pauling sviluppò ulteriormente una scala mobile del tipo a legame governata dall'elettronegatività degli atomi coinvolti nel legame..
Gli immensi contributi di Pauling alla nostra moderna comprensione dei legami chimici gli hanno portato nel 1954 il Premio Nobel per "l'indagine sulla natura del legame chimico e la sua applicazione per chiarire la struttura di sostanze complesse".
Gli esseri viventi sono costituiti da atomi, ma nella maggior parte dei casi quegli atomi non fluttuano individualmente. Invece, normalmente interagiscono con altri atomi (o gruppi di atomi).
Ad esempio, gli atomi possono essere collegati da forti legami e organizzati in molecole o cristalli. Oppure possono formare legami temporanei e deboli con altri atomi che entrano in collisione con loro..
Sia i legami forti che legano le molecole che i legami deboli che creano connessioni temporanee sono essenziali per la chimica del nostro corpo e per l'esistenza della vita stessa..
Gli atomi tendono a disporsi negli schemi più stabili possibili, il che significa che hanno la tendenza a completare o riempire le loro orbite elettroniche più esterne..
Si legano ad altri atomi per fare proprio questo. La forza che tiene insieme gli atomi in raccolte note come molecole è nota come legame chimico..
Tipi di legami chimici interatomici
Legame metallico
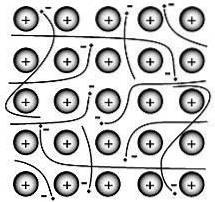
Il legame metallico è la forza che tiene insieme gli atomi in una sostanza metallica pura. Un tale solido è costituito da atomi strettamente imballati.
Nella maggior parte dei casi, il guscio elettronico più esterno di ciascuno degli atomi di metallo si sovrappone a un gran numero di atomi vicini. Di conseguenza, gli elettroni di valenza si spostano continuamente da un atomo all'altro e non sono associati a nessuna coppia specifica di atomi..
I metalli hanno diverse qualità uniche, come la capacità di condurre elettricità, bassa energia di ionizzazione e bassa elettronegatività (quindi cedono facilmente gli elettroni, cioè sono cationi)..
Le loro proprietà fisiche includono un aspetto brillante (brillante) e sono malleabili e duttili. I metalli hanno una struttura cristallina. Tuttavia, i metalli sono anche malleabili e duttili.
Nel 1900, Paul Drüde inventò la teoria del mare degli elettroni modellando i metalli come una miscela di nuclei atomici (nuclei atomici = nuclei positivi + guscio elettronico interno) ed elettroni di valenza..
In questo modello, gli elettroni di valenza sono liberi, delocalizzati, mobili e non associati a nessun particolare atomo..
Legame ionico
I legami ionici sono di natura elettrostatica. Si verificano quando un elemento con una carica positiva si unisce a uno con una carica negativa mediante interazioni coulombiche.
Gli elementi con basse energie di ionizzazione hanno la tendenza a perdere facilmente gli elettroni mentre gli elementi con un'elevata affinità elettronica hanno la tendenza a guadagnarli producendo rispettivamente cationi e anioni, che sono quelli che formano legami ionici..
I composti che mostrano legami ionici formano cristalli ionici in cui ioni positivi e caricati negativamente oscillano vicini l'uno all'altro, ma non c'è sempre una correlazione 1-1 diretta tra ioni positivi e negativi..
I legami ionici possono tipicamente essere rotti attraverso l'idrogenazione o l'aggiunta di acqua a un composto.
Le sostanze tenute insieme da legami ionici (come il cloruro di sodio) possono comunemente separarsi in veri ioni carichi quando agite da una forza esterna, come quando sono disciolte in acqua..
Inoltre, in forma solida, i singoli atomi non sono attratti da un singolo vicino, ma formano invece reti giganti attratte l'una dall'altra dalle interazioni elettrostatiche tra il nucleo di ciascun atomo e gli elettroni di valenza vicini..
La forza di attrazione tra atomi vicini conferisce ai solidi ionici una struttura estremamente ordinata nota come reticolo ionico, in cui le particelle caricate in modo opposto si allineano tra loro per creare una struttura rigida strettamente legata..

Legame covalente
Il legame covalente si verifica quando le coppie di elettroni sono condivise dagli atomi. Gli atomi si uniranno in modo covalente con altri atomi per ottenere maggiore stabilità, che si ottiene formando un guscio elettronico completo.
Condividendo i loro elettroni più esterni (valenza), gli atomi possono riempire il loro guscio esterno di elettroni e ottenere stabilità..
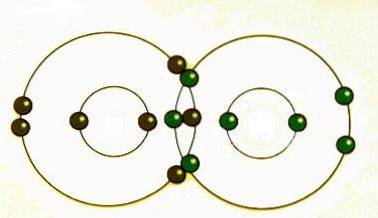
Sebbene si dice che gli atomi condividano gli elettroni quando formano legami covalenti, spesso non condividono gli elettroni allo stesso modo. Solo quando due atomi dello stesso elemento formano un legame covalente gli elettroni condivisi sono effettivamente condivisi equamente tra gli atomi..
Quando atomi di elementi diversi condividono elettroni attraverso il legame covalente, l'elettrone verrà attirato ulteriormente verso l'atomo con la più alta elettronegatività risultante in un legame covalente polare..
Rispetto ai composti ionici, i composti covalenti di solito hanno un punto di fusione e di ebollizione più basso e hanno meno probabilità di dissolversi in acqua..
I composti covalenti possono essere allo stato gassoso, liquido o solido e non conducono bene l'elettricità o il calore..
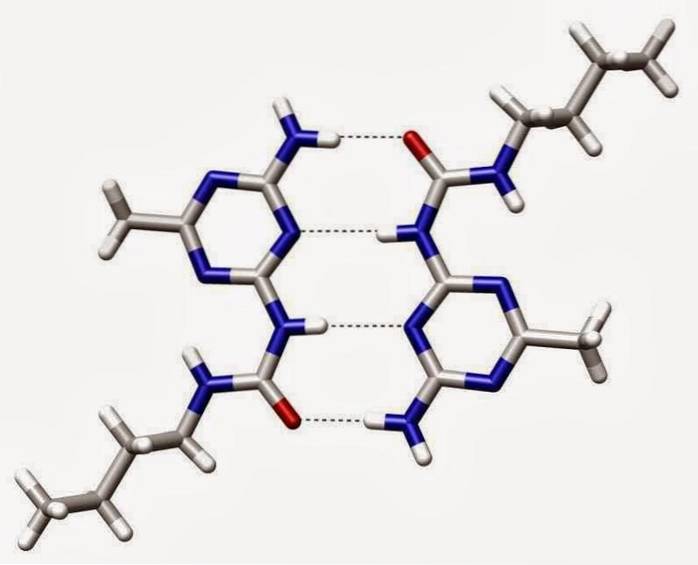
Legami di idrogeno
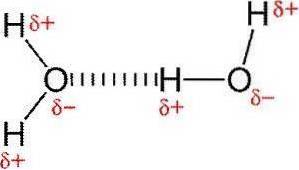
I legami idrogeno o legami idrogeno sono interazioni deboli tra un atomo di idrogeno attaccato a un elemento elettronegativo con un altro elemento elettronegativo.
In un legame covalente polare che contiene idrogeno (ad esempio, un legame O-H in una molecola d'acqua), l'idrogeno avrà una leggera carica positiva perché gli elettroni di legame vengono attratti più fortemente verso l'altro elemento..
A causa di questa leggera carica positiva, l'idrogeno sarà attratto da eventuali cariche negative vicine..
Collegamenti a Van der Waals
Sono forze elettriche relativamente deboli che attraggono reciprocamente molecole neutre nei gas, nei gas liquefatti e solidificati e in quasi tutti i liquidi organici e solidi..
Le forze prendono il nome dal fisico olandese Johannes Diderik van der Waals, che nel 1873 postulò per primo queste forze intermolecolari nello sviluppo di una teoria per spiegare le proprietà dei gas reali..
Forze di Van der Waals è un termine generico usato per definire l'attrazione delle forze intermolecolari tra le molecole..
Esistono due classi di forze di Van der Waals: le forze di dispersione di Londra che sono forze dipolo-dipolo deboli e più forti..
Riferimenti
- Anthony Capri, A. D. (2003). Legame chimico: la natura del legame chimico. Estratto da visionlearning visionlearning.com
- Camy Fung, N. M. (2015, 11 agosto). Legami covalenti. Tratto da chem.libretexts chem.libretexts.org
- Clark, J. (2017, 25 febbraio). Incollaggio metallico. Tratto da chem.libretexts chem.libretexts.org
- Encyclopædia Britannica. (2016, 4 aprile). Legame metallico. Tratto da britannica britannica.com.
- Encyclopædia Britannica. (2016, 16 marzo). Forze di Van der Waals. Tratto da britannica britannica.com
- Kathryn Rashe, L. P. (2017, 11 marzo). Le forze di Van der Waals. Tratto da chem.libretexts chem.libretexts.org.
- Khan, S. (S.F.). Legami chimici. Tratto da khanacademy khanacademy.org.
- Martinez, E. (2017, 24 aprile). Cos'è il legame atomico? Tratto da sciencing sciencing.com.
- Wyzant, Inc. (S.F.). Obbligazioni. Tratto da wyzant wyzant.com.



Nessun utente ha ancora commentato questo articolo.