
Parti ed esempi di equazioni chimiche

Il equazione chimica è una rappresentazione schematica di alcune delle caratteristiche di una reazione chimica. Si può anche dire che l'equazione chimica descrive i cambiamenti subiti dalle diverse sostanze coinvolte in una reazione.
Le formule e i simboli delle diverse sostanze partecipanti sono posti nell'equazione chimica, indicando chiaramente il numero di atomi di ogni elemento presente nei composti, che appare come un pedice e non può essere modificato bilanciando l'equazione.
L'equazione chimica deve apparire equilibrata, ovvero il numero di atomi sia dei reagenti che dei prodotti deve essere uguale. In questo modo si obbedisce alla legge di conservazione della materia. È auspicabile che i numeri utilizzati per bilanciare le equazioni siano numeri interi.
Queste equazioni non rivelano i passaggi consecutivi, né da quali meccanismi i reagenti vengono trasformati in prodotti..
Ecco perché, sebbene siano molto utili per capire dove sta andando una reazione chimica, non ci permettono di comprenderne gli aspetti molecolari o come essa sia influenzata da determinate variabili; come pH, viscosità, tempo di reazione, velocità di agitazione, tra gli altri.
Indice articolo
- 1 Parti di un'equazione chimica
- 1.1 Posizione di reagenti e prodotti
- 1.2 Bilanciamento delle equazioni chimiche
- 1.3 Stati fisici dei componenti dell'equazione chimica
- 1.4 Cambiamenti nello stato fisico
- 2 Esempio di equazioni chimiche
- 2.1 - Fotosintesi
- 2.2 - Respirazione cellulare
- 2.3 - Reazioni di elementi comuni
- 3 Riferimenti
Parti di un'equazione chimica
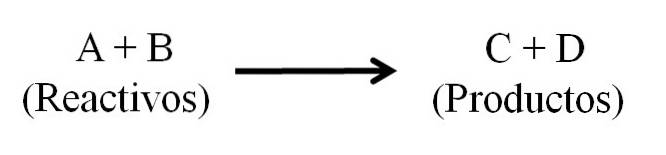
Ci sono fondamentalmente tre parti principali di un'equazione chimica: i reagenti, i prodotti e la freccia che indica la direzione della reazione chimica..
Ubicazione di reagenti e prodotti
Tutte le sostanze che funzionano come reagenti e tutti quelli che sono prodotti compaiono nell'equazione chimica. Questi gruppi di sostanze sono separati da una freccia che indica la direzione della reazione. I reagenti si trovano a sinistra della freccia e i prodotti a destra.
La freccia indica ciò che viene prodotto ed è orientata da sinistra a destra (→), sebbene nelle reazioni reversibili ci siano due frecce equivalenti e parallele; uno diretto a destra e uno a sinistra. Il simbolo (Δ) è solitamente posizionato sopra la freccia, a indicare che il calore è stato utilizzato nella reazione..
Inoltre, l'identificazione del catalizzatore è solitamente posta sulla freccia, se possibile con la sua formula o il suo simbolo. Le diverse sostanze che appaiono come reagenti sono separate dal segno (+), che indica che le sostanze reagiscono o si combinano tra loro.
Nel caso di sostanze che appaiono come prodotti, il segno (+) non ha la connotazione precedente; a meno che la reazione non sia reversibile. È conveniente che il segno (+) sia posto equidistante dalle sostanze che separa.
Bilanciamento di equazioni chimiche
È un requisito essenziale che le equazioni chimiche siano adeguatamente bilanciate. Per questo, viene inserito un numero chiamato coefficiente stechiometrico. Se necessario, questo coefficiente deve precedere le sostanze che appaiono come reagenti o prodotti..
Questo per ottenere che il numero di tutti gli atomi degli elementi che appaiono come reagenti sia esattamente uguale al numero di essi che compaiono nel prodotto. Il metodo più semplice per bilanciare le equazioni chimiche è per tentativi ed errori..
Stati fisici dei componenti dell'equazione chimica
In alcune equazioni chimiche lo stato fisico delle sostanze è contrassegnato da un pedice. Per questo, in spagnolo vengono utilizzate le seguenti abbreviazioni: (s) per lo stato solido; (l) per lo stato liquido; (g), allo stato gassoso; e (ac), soluzione acquosa.
Esempio: reazione del carbonato di calcio con acido cloridrico.
Ladro3 (s) + 2 HCl(AC) → CaCl2 (s) + HDueO(l) + CO2 g)
Cambiamenti nello stato fisico
In alcuni casi, è indicato nell'equazione chimica se c'è produzione di un gas nella reazione chimica o se c'è la precipitazione di una qualsiasi delle sostanze prodotte.
La presenza di un gas è indicata da una freccia verticale con la sua estremità rivolta verso l'alto (↑), posta sul lato destro della sostanza gassosa.
Esempio: reazione dello zinco con acido cloridrico.
Zn + 2 HCl → ZnClDue + HDue↑
Se nella reazione chimica una delle sostanze forma un precipitato, questo è simboleggiato ponendo una freccia verticale con la sua estremità rivolta verso il basso (↓), posta sul lato destro della sostanza precipitata..
Esempio: reazione dell'acido cloridrico con nitrato d'argento.
HCl + AgNO3 → HNO3 + AgCl ↓
Esempio di equazioni chimiche
- Fotosintesi

La fotosintesi è un processo mediante il quale le piante catturano e trasformano l'energia luminosa, proveniente dalla luce solare, per generare l'energia necessaria alla loro sussistenza. La fotosintesi viene eseguita da alcuni organelli di cellule vegetali chiamati cloroplasti.
I tilacoidi si trovano nella membrana dei cloroplasti, siti in cui si trovano le clorofille. per Y b, quali sono i principali pigmenti che catturano l'energia luminosa.
Sebbene la fotosintesi sia un processo complesso, può essere delineato nella seguente equazione chimica:
6 CODue + 6 hDueO → C6H12O6 + 6 ODue↑ ΔGº = 2.870 kJ / mol
C6H12O6 È la formula del glucosio, un carboidrato metabolizzato per la produzione di ATP; composto che è il principale serbatoio di energia nella maggior parte degli esseri viventi. Inoltre, il NADPH è generato dal glucosio, un coenzima necessario per molte reazioni..
- Respirazione cellulare
Le cellule utilizzano l'ossigeno per il metabolismo di numerose sostanze presenti negli alimenti ingeriti. Nel frattempo, l'ATP viene utilizzato come fonte di energia per le attività svolte dagli esseri viventi, producendo anidride carbonica e acqua in questi processi..
Se il glucosio viene utilizzato come modello per una sostanza metabolizzata, la respirazione può essere schematizzata utilizzando la seguente equazione chimica:
C6H12O6 + 6 ODue → 6 CODue + 6 hDueO
- Reazioni degli elementi comuni
Reazione di decomposizione
Uno o più composti si dissociano, formando altri composti diversi con i loro atomi:
2 KClO3 (s) → 2 KCl(S) + 3 O2 g)
Reazione di spostamento
Un metallo reagisce con un composto, sostituendo un metallo presente in esso:
Mg(S) + CORSO4 (ac) → Cu(S) + MgSO4 (ac)
Reazione di eliminazione
In questo tipo di reazione, il numero di atomi o gruppi attaccati a un atomo di carbonio diminuisce:
CH3-CHDueBr + NaOH → HDueC = CHDue + HDueO + NaBr
Reazione di idratazione
È una reazione in cui un composto aggiunge una molecola di acqua. Questa reazione è importante nella preparazione degli alcoli:
HDueC = CHDue + HDueO → HDueC-CHDueOh
Reazione di neutralizzazione
Una base o alcali reagisce con un acido producendo un sale e acqua:
HCl(AC) + NaOH(AC) → NaCl(AC) + HDueO(l)
Reazione di sintesi
In questo tipo di reazione, due o più sostanze vengono combinate per creare un nuovo composto:
2 Li(S) + Cl2 g) → 2 LiCl(S)
Doppia reazione di spostamento (metatesi)
In questo tipo di reazione c'è scambio di ioni positivi e negativi per formare nuovi composti:
AgNO3 (ac) + NaCl(AC) → AgCl(S) + Fratello maggiore3 (ac)
Riferimenti
- Flores, J. (2002). Chimica. Edizione 1era. Editoriale Santillana
- Mathews, C. K., Van Holde, K. E. e Ahern, K. G. (2002). Biochimica. 3era Edizione. Editore Pearson Addison Wesley
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Wikipedia. (2019). Equazione chimica. Estratto da: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20 settembre 2019). Che cosa è una equazione chimica? Estratto da: thoughtco.com

Nessun utente ha ancora commentato questo articolo.