
Metile o gruppo metile
Il gruppo metile o metile è un sostituente alchilico la cui formula chimica è CH3. È il più semplice di tutti i sostituenti del carbonio in chimica organica, ha un unico carbonio e tre idrogeni; deriva dal gas metano. Poiché può legarsi solo a un altro carbonio, la sua posizione indica la fine di una catena, la sua terminazione.
Nell'immagine sotto c'è una delle tante rappresentazioni per questo gruppo. Le curve alla sua destra indicano che dietro il collegamento H.3C- può essere qualsiasi atomo o sostituente; un gruppo alchilico, R, aromatico o arile, Ar, o un eteroatomo o funzionale, come OH o Cl.

Quando il gruppo funzionale attaccato al metile è OH, abbiamo l'alcol metanolo, CH3OH; e se è Cl, avremo cloruro di metile, CH3Cl. Nella nomenclatura organica è indicato semplicemente come 'metile' preceduto dal numero della sua posizione nella catena di carbonio più lunga.
Il gruppo metilico CH3 è facile da identificare durante le delucidazioni di strutture organiche, soprattutto grazie alla spettroscopia di risonanza magnetica nucleare al carbonio 13 (C NMR13). Da esso, dopo forti ossidazioni, si ottengono gruppi acidi COOH, essendo una via sintetica per sintetizzare acidi carbossilici.
Indice articolo
- 1 Rappresentazioni
- 2 Struttura
- 3 Proprietà
- 4 Reattività
- 4.1 Ossidazioni
- 4.2 Ioni
- 4.3 Reazione di metilazione
- 5 Riferimenti
Rappresentazioni
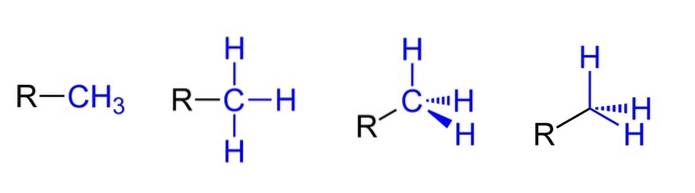
Sopra abbiamo le quattro possibili rappresentazioni assumendo che CH3 è legato ad un sostituente alchilico R. Tutti sono equivalenti, ma andando da sinistra a destra sono evidenti gli aspetti spaziali della molecola.
Ad esempio, R-CH3 dà l'impressione che sia piatto e lineare. La rappresentazione che segue mostra i tre legami covalenti C-H, che consentono di identificare il metile in qualsiasi struttura di Lewis e danno la falsa impressione di essere una croce..
Quindi, proseguendo verso destra (la penultima), si osserva l'ibridazione sp3 sul carbonio di CH3 a causa della sua geometria tetraedrica. Nell'ultima rappresentazione, il simbolo chimico del carbonio non è nemmeno scritto, ma il tetraedro viene mantenuto per indicare quali atomi di H si trovano davanti o dietro il piano..
Sebbene non sia nell'immagine, un altro modo molto ricorrente quando si rappresenta il CH3 consiste nel mettere semplicemente il trattino (-) "nudo". Questo è molto utile quando si disegnano scheletri di carbonio di grandi dimensioni..
Struttura

L'immagine in alto è la rappresentazione tridimensionale della prima. La sfera nera lucida corrisponde all'atomo di carbonio, mentre quelle bianche sono gli atomi di idrogeno.
Anche in questo caso, il carbonio ha un prodotto ambientale tetraedrico della sua ibridazione sp3, e come tale è un gruppo relativamente voluminoso, con le rotazioni del suo legame C-R stericamente ostacolate; cioè, non può ruotare perché le sfere bianche interferirebbero con le nuvole elettroniche dei loro atomi vicini e sentirebbero la loro repulsione.
Tuttavia, i legami C-H possono vibrare, proprio come il legame C-R. Pertanto, il CH3 è un gruppo di geometria tetraedrica che può essere chiarito (determinato, accertato) mediante spettroscopia di radiazione infrarossa (IR), come tutti i gruppi funzionali e legami di carbonio con eteroatomi.
La cosa più importante, tuttavia, è la sua delucidazione mediante C-NMR.13. Grazie a questa tecnica, viene determinata la quantità relativa di gruppi metilici, che consente di assemblare la struttura molecolare..
Generalmente, più gruppi CH3 avere una molecola, più "goffe" o inefficienti saranno le sue interazioni intermolecolari; ovvero, minore sarà il loro punto di fusione e di ebollizione. Gruppi CH3, a causa dei loro idrogeni, "scivolano" l'uno contro l'altro quando si avvicinano o si toccano.
Proprietà
Il gruppo metile è caratterizzato dall'essere essenzialmente idrofobo e apolare.
Questo perché i loro legami C-H non sono molto polari a causa della bassa differenza tra le elettronegatività del carbonio e dell'idrogeno; Inoltre, la sua geometria tetraedrica e simmetrica distribuisce le sue densità di elettroni in modo quasi omogeneo, il che contribuisce a un momento di dipolo trascurabile..
In assenza di polarità, il CH3 "Fuga" dall'acqua, comportandosi come un idrofobo. Pertanto, se viene visto in una molecola, sarà noto che questa estremità metilica non interagirà in modo efficiente con l'acqua o un altro solvente polare..
Un'altra caratteristica del CH3 è la sua relativa stabilità. A meno che l'atomo che è legato ad esso non rimuova la sua densità elettronica, rimane praticamente inerte a mezzi acidi molto forti. Tuttavia, si vedrà che può partecipare a reazioni chimiche, principalmente per quanto riguarda la sua ossidazione o migrazione (metilazione) verso un'altra molecola.
Reattività
Ossidazioni
Il CH3 non è esente da ruggine. Ciò significa che è suscettibile di formare legami con l'ossigeno, CO, se reagisce con forti agenti ossidanti. Man mano che si ossida, si trasforma in diversi gruppi funzionali.
Ad esempio, la sua prima ossidazione dà origine al gruppo methiol (o idrossimetile), CHDueOH, un alcol. Il secondo deriva nel gruppo formile, CHO (HC = O), un'aldeide. E il terzo, infine, consente la sua conversione nel gruppo carbossilico, COOH, un acido carbossilico.
Questa serie di ossidazioni viene utilizzata per sintetizzare l'acido benzoico (HOOC-C6H5) dal toluene (H.3DC6H5).
Ion
Il CH3 durante il meccanismo di alcune reazioni può accumulare cariche elettriche momentanee. Ad esempio, quando il metanolo viene riscaldato in un mezzo acido molto forte, in assenza teorica di nucleofili (cercatori di cariche positive), il catione metilico, CH3+, poiché il legame CH è rotto3-OH e OH lascia con la coppia di elettroni del legame.
La specie CH3+ è così reattivo che è stato determinato solo in fase gassosa, poiché reagisce o scompare alla minima presenza di un nucleofilo.
D'altra parte, il CH3 si può anche ottenere un anione: metanide, CH3-, il più semplice carbanion di tutti. Tuttavia, come il cap3+, la sua presenza è anormale e si verifica solo in condizioni estreme.
Reazione di metilazione
Nella reazione di metilazione, viene trasferito un CH3 a una molecola senza produrre cariche elettriche (CH3+ né CH3-) nel processo. Ad esempio, ioduro di metile, CH3I, è un buon agente metilante e può sostituire il legame O-H di diverse molecole con un O-CH3.
Nella sintesi organica ciò non comporta alcuna tragedia; ma sì, quando ciò che è metilato in eccesso sono le basi azotate del DNA.
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Rahul Gladwin. (23 novembre 2018). Metilazione. Encyclopædia Britannica. Estratto da: britannica.com
- Danielle Reid. (2019). Gruppo metilico: struttura e formula. Studia. Estratto da: study.com
- Wikipedia. (2019). Gruppo metile. Estratto da: en.wikipedia.org



Nessun utente ha ancora commentato questo articolo.