
Sintomi, cause, trattamenti della malattia di Canavan
Il Malattia di Canavan È una malattia genetica rara che si verifica perché le cellule nervose del cervello sono danneggiate e non sono in grado di comunicare tra loro. Questa malattia è presente in qualsiasi società e gruppo etnico, sebbene sia molto più frequente nella popolazione ebrea ashkenazita e nei suoi discendenti, dove ne è affetta 1 persona su 6.400-13.000. La prevalenza globale è sconosciuta.
Questa malattia rientra nel gruppo delle leucodistrofie. Questa categoria comprende tutte le malattie genetiche in cui la guaina mielinica che circonda gli assoni dei neuroni è danneggiata e, quindi, non c'è una buona comunicazione tra i neuroni.
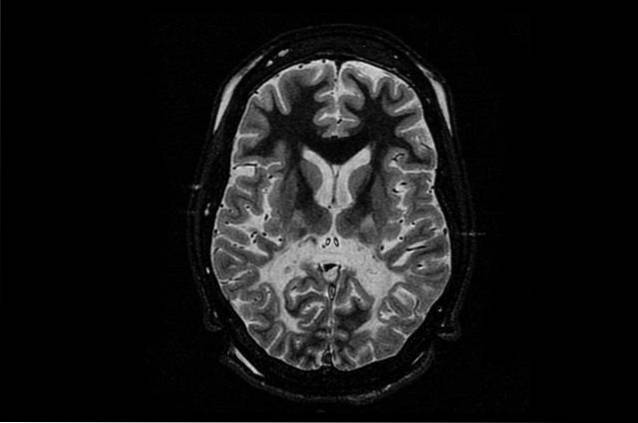
La forma più comune e, allo stesso tempo, più grave di questa malattia è neonatale o infantile. Questa forma di malattia di Canavan colpisce i neonati o nei primi anni di vita..
I bambini che soffrono di questa malattia non presentano alcun problema durante i primi mesi di vita, ma questi iniziano a fiorire tra i 3 ed i 5 mesi. I sintomi principali sono dovuti al deficit nello sviluppo, dove i bambini hanno problemi motori che impediscono loro di girarsi, girare la testa o sedersi senza alcun supporto.
Altri sintomi comuni sono debolezza muscolare (ipotonia), sviluppo anomalo della testa (macrocefalia) e irritabilità. In misura minore, possono anche avere problemi a mangiare, convulsioni e problemi di sonno..
Un'altra forma meno comune è la malattia di Canavan che inizia nella metà dell'infanzia o dell'adolescenza. I bambini e gli adolescenti con questa malattia hanno problemi con lo sviluppo del linguaggio e le capacità motorie, ma questi problemi sono spesso così lievi da non essere identificati come sintomi della malattia di Canavan..
L'aspettativa di vita delle persone con malattia di Canavan è molto eterogenea e varia notevolmente a seconda del momento di insorgenza della malattia.
I bambini che soffrono della forma neonatale o infantile di solito vivono solo pochi anni, anche se alcuni raggiungono l'adolescenza e pochissimi fino all'età adulta. Mentre chi soffre della forma giovanile ha un'aspettativa di vita normale.
Indice articolo
- 1 sintomi
- 1.1 Iniziazione neonatale o infantile
- 1.2 Media infanzia o adolescenza
- 2 Cause
- 3 Trattamento
- 3.1 Trattamento per la malattia di Canavan neonatale o infantile
- 3.2 Trattamento per la malattia di Canavan della mezza infanzia o dell'adolescenza
- 4 Nuove terapie di trattamento
- 4.1 Studi sull'uomo
- 4.2 Studi sugli animali
- 5 Diagnosi
- 6 Riferimenti
Sintomi
Esistono due forme ben differenziate di malattia di Canavan: quella a esordio neonatale o infantile e quella a esordio nella mezza infanzia o adolescenza..
Esordio neonatale o infantile
I sintomi della malattia di Canavan ad esordio neonatale o infantile sono molto gravi, di solito non si notano fino a 3-50 mesi di età e comprendono macrocefalia, perdita del controllo motorio della testa e deficit dello sviluppo. I deficit dello sviluppo diventano più evidenti man mano che il bambino cresce.
I sintomi più gravi sono quelli legati ai problemi motori, poiché i bambini non sono in grado di sedersi o alzarsi senza supporto, camminare o parlare. Quando invecchiano, l'ipotonia può portare alla spasticità.
Sebbene abbiano tutti questi problemi motori, possono imparare a interagire socialmente, sorridere, indicare oggetti ...
Alcuni bambini soffrono anche di atrofia ottica, che causa problemi visivi, sebbene possano comunque identificare visivamente gli oggetti.
Man mano che i sintomi crescono, peggiorano, causando disturbi del sonno, convulsioni e problemi di alimentazione. Il bambino diventa totalmente dipendente e necessita di aiuto per svolgere qualsiasi compito.
L'aspettativa di vita di questi bambini è piuttosto breve, la maggior parte muore in pochi anni, anche se alcuni vivono fino all'adolescenza o all'età adulta.
Media infanzia o adolescenza
La malattia di Canavan con esordio nella mezza infanzia o nell'adolescenza è più lieve della precedente. I sintomi includono alcune difficoltà nello sviluppo verbale e motorio.
Sebbene di solito siano così lievi da non essere identificati come sintomi della malattia di Canavan, questa malattia viene solitamente diagnosticata dopo aver eseguito un'analisi delle urine, poiché uno dei marker è l'alta concentrazione di acido N-acetilaspartico (NAA nelle urine.
Cause
Questa malattia è causata da una mutazione in un gene chiamato ASPA. Questo gene è quello che controlla l'enzima aspartoacilasi, responsabile della degradazione delle molecole di NAA..
La mutazione del gene ASPA fa sì che l'aspartoacilasi riduca la sua efficacia, quindi non degraderà abbastanza molecole di NAA e ci sarà un'alta concentrazione di questa sostanza. Prima si verifica questa mutazione, peggiori sono gli effetti che ha.
Sebbene il funzionamento delle molecole NAA non sia molto ben compreso, sembra che siano coinvolte nel trasporto di molecole d'acqua attraverso i neuroni e, l'eccesso di questa sostanza, impedisce la formazione di nuova mielina e distrugge quella esistente. Ciò fa sì che le connessioni tra i neuroni non funzionino correttamente e il cervello non sia in grado di svilupparsi normalmente..
Inoltre, questa malattia può essere ereditata in modo autosomico recessivo. Quindi, se ogni membro della coppia è portatore della variante patogena del gene ASPA e decide di avere un figlio, è probabile che:
- Il bambino ha la malattia nel 25% dei casi.
- Il bambino è portatore nel 50% dei casi, ma non ha problemi.
- Il bambino non è nemmeno un portatore nel 25%.
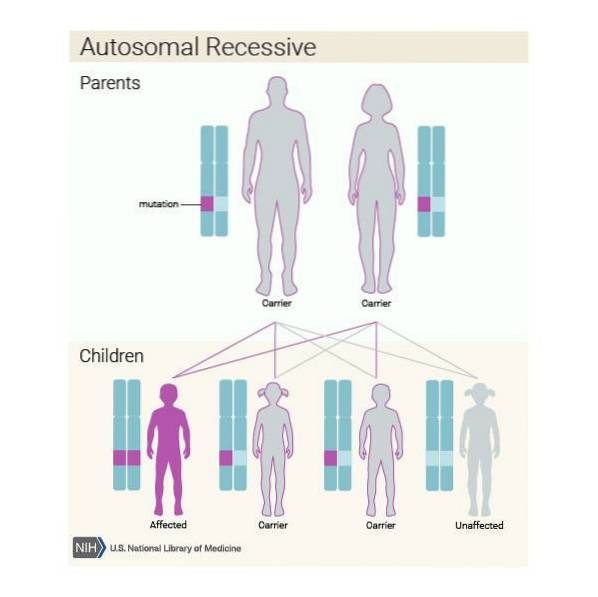
È molto importante che gli individui appartenenti alla popolazione a rischio, in questo caso i discendenti degli ebrei ashkenaziti, vengano sottoposti ad un'analisi genetica per verificare se sono portatori del gene ASPA prima di avere un figlio..
Trattamento
Il trattamento dipende dalla forma della malattia e dai sintomi che ogni individuo presenta..
Trattamento per la malattia di Canavan neonatale o infantile
Al momento non esiste una cura per la malattia di Canavan, quindi le terapie disponibili si concentrano sul miglioramento della qualità della vita del paziente sostenendo, nutrendo e idratando e prevenendo e curando le infezioni..
Si raccomanda che i bambini ricevano un trattamento fisioterapico per migliorare la postura e le capacità motorie, per evitare e curare contratture e problemi muscolari, come le ulcere da pressione. Possono anche partecipare a programmi terapeutici ed educativi per migliorare le loro capacità di comunicazione..
Il trattamento con farmaci comprende farmaci antiepilettici (DAE) se il bambino ha convulsioni, acetazolamide (marca Diamox®) per ridurre la pressione intracranica e le iniezioni di tossina botulinica (Botox®) per trattare la spasticità se presente.
È necessario effettuare un follow-up ogni 6 mesi per verificare in che stato si trova il bambino e come sta andando il suo sviluppo.
Trattamento per la malattia di Canavan della mezza infanzia o dell'adolescenza
Le persone che soffrono di questa forma della malattia sperimentano sintomi molto più lievi, quindi di solito hanno solo bisogno di terapie per migliorare il loro linguaggio o programmi educativi speciali. Non hanno bisogno di farmaci.
Si raccomanda un monitoraggio annuale delle condizioni del bambino.
Nuove terapie di trattamento
L'efficacia di altre terapie è attualmente allo studio su modelli sia umani che animali..
Studi sull'uomo
- Vettore non virale
Si sta studiando l'efficacia di un trapianto genetico al cervello di bambini con malattia di Canavan, utilizzando un vettore non virale.
I primi risultati mostrano che questo tipo di trapianto è ben tollerato dai bambini e provoca alcuni cambiamenti biochimici, radiologici e metabolici, ma non è utile per curare la malattia, quindi i test sono ancora in corso (Leone et al 2000, Janson et al. . al 2002).
- Vector VAAV2
McPhee et al. (2006) stanno conducendo uno studio in cui il gene sano ASPA viene trapiantato in vari punti del corpo dei bambini, utilizzando AAV2 come vettore. In uno dei test a cui hanno partecipato 10 bambini volontari. In 3 di loro il trapianto ha funzionato e ha neutralizzato i loro anticorpi, ma nessuno dei bambini è migliorato.
- Citrato di litio
Il citrato di litio può ridurre il livello di concentrazione di NAA nel cervello, motivo per cui Assadi et al. (2010) hanno deciso di condurre un esperimento in cui hanno somministrato citrato di litio a 6 persone con malattia di Canavan per 60 giorni.
Sono stati trovati livelli di concentrazione di NAA nei gangli della base e nella sostanza bianca del lobo frontale, sebbene non siano stati riscontrati miglioramenti clinici.
- Triacetato di glicerolo
La mancanza di enzimi aspartoacilasi causa bassi livelli di acetato nel cervello, quindi Mahavarao e il suo team (2009) hanno deciso di somministrare triacetato di glicerolo a due pazienti con malattia di Canaval per aumentare i livelli di acetato e vedere se questo aumentava anche i livelli di aspartoacilasi.
Il composto è stato ben tollerato dai pazienti, sebbene non siano stati riscontrati miglioramenti clinici. Attualmente stanno conducendo test che somministrano una quantità maggiore di triacetato di glicerolo.
Studi sugli animali
Uno dei modi per creare modelli animali che rappresentano una malattia è creare animali tramortire. Questi animali, di solito i topi, sono geneticamente modificati per rimuovere o cambiare il gene che è alterato nella malattia. In questo caso, il gene modificato è il gene ASPA..
I modelli animali vengono utilizzati per comprendere meglio la malattia, studiarne il correlato biologico e verificare l'efficacia di nuovi trattamenti.
Matalon et al. (2003) hanno utilizzato topi tramortire testare l'efficacia di una terapia genica con AAV2 come vettore. Hanno scoperto che c'erano stati miglioramenti nelle guaine mieliniche, ma solo in alcune parti, non in tutto il cervello.
Il team di Surendran in collaborazione con la Genzyme Corporation (2004), ha testato un trattamento di trapianto di cellule staminali. Hanno scoperto che erano stati prodotti nuovi oligodendrociti, ma non abbastanza per ripristinare tutte le guaine mieliniche..
Un altro team ha testato una terapia che consisteva nel sostituire gli enzimi asparthoacyclase malfunzionanti con nuovi enzimi iniettati nel peritoneo dei topi. tramortire.
I risultati a breve termine hanno mostrato che gli enzimi sono stati in grado di superare la barriera emato-encefalica (raggiungendo il loro obiettivo) e sono stati in grado di ridurre significativamente i livelli di NAA nel cervello. Sebbene questi risultati siano promettenti, è necessario uno studio longitudinale per verificare gli effetti a lungo termine (Zano et al., 2011).
Diagnosi
I primi segnali che avvisano i medici che qualcosa non va sono quelli fisici, soprattutto ipotonia e macrocefalia.
Normalmente, se si osservano questi segni, viene solitamente eseguito uno studio di neuroimaging nel bambino per verificare la presenza di segni di leucodistrofia, come una minore densità di sostanza bianca. Va notato che questo test è meno efficace nei bambini con malattia di Canavan che inizia nella metà dell'infanzia o dell'adolescenza..
Una volta dimostrato che il bambino soffre di leucodistrofia, vengono eseguiti test più specifici per escludere altre malattie, tra cui:
- Controlla i livelli di NAA con:
- Analisi delle urine.
- Analisi del liquido amniotico (se il bambino non è ancora nato).
- Controllare l'attività degli enzimi ciclasi dell'acido aspartico attraverso:
- Colture di cellule della pelle per controllare i livelli di fibroblasti (sebbene questo test non sia affidabile).
- Livelli di questo enzima nei globuli bianchi e nelle piastrine.
- Amniociti (cellula fetale) se il bambino non è ancora nato.
L'ultimo passaggio per confermare la malattia sarebbe eseguire uno studio genetico come segue:
- Viene verificato se sono presenti alcune delle varianti patogene del gene ASPA (le più note sono p.Glu285Ala, p.Tyr231Ter e p.Ala305Glu).
- Se solo una di queste varianti è presente o nessuna è presente, viene eseguita un'analisi di sequenziamento..
- Se nell'analisi di sequenziamento viene trovata solo una variante o nessuna, viene eseguita un'analisi di duplicazione e cancellazione.
Riferimenti
- Assadi M, Janson C, Wang DJ, Goldfarb O, Suri N, Bilaniuk L, Leone P. Il citrato di litio riduce l'eccessivo N-acetil aspartato intra-cerebrale nella malattia di Canavan. Eur J Paediatr Neurol. 2010; 14: 354-9.
- Janson C, McPhee S, Bilaniuk L, Haselgrove J, Testaiuti M, Freese A, Wang DJ, Shera D, Hurh P, Rupin J, Saslow E, Goldfarb O, Goldberg M, Larijani G, Sharrar W, Liouterman L, Campo A , Kolodny E, Samulski J, Leone P.
- Matalon, R. e Michals-Matalon, K. (2011). Malattia di Canavan. In R. Pagon, M. Adam e H. Ardinger, GeneReviews (p. Internet). Seattle: Università di Washington.
- Istituto nazionale di sanità, NIH. (21 giugno 2016). Malattia di Canavan. Ottenuto da Genetics Home Reference.
- Zano S, Malik R, Szucs S, Matalon R, Viola RE. Modifica dell'aspartoacilasi per un potenziale utilizzo nella terapia enzimatica sostitutiva per il trattamento della malattia di Canavan. Mol Genet Metab. 2011; 102: 176-80.

Nessun utente ha ancora commentato questo articolo.