
Concetti ed esempi di divisibilità chimica

Possiamo definire il file divisibilità in chimica come proprietà della materia che ne consente la separazione in porzioni più piccole. Per capire il concetto possiamo fare un esempio.
Se prendiamo una pagnotta e la tagliamo a metà più e più volte, arriveremo mai a un blocco fondamentale di materia che non può essere ulteriormente diviso? Questa domanda è stata nella mente di scienziati e filosofi per migliaia di anni.
Origine e concetto di divisibilità chimica
Per molto tempo si è discusso se la materia fosse composta da particelle (ciò che oggi conosciamo come atomi), tuttavia, l'idea generale era che la materia fosse un continuum che poteva essere diviso.
Questo concetto diffuso rese scienziati brillanti come James Clerk Maxwell (delle equazioni di Maxwell) e Ludwing Boltzman (della distribuzione Boltzman) vittime del ridicolo, che portò il primo alla follia e il secondo al suicidio..
Nel V secolo a.C., il filosofo greco Leucippo e il suo discepolo Democrito usarono la parola atomi per designare il più piccolo pezzo di materia individuale e proposero che il mondo non fosse altro che atomi in movimento..
Questa prima teoria atomica differiva dalle versioni successive in quanto includeva l'idea di un'anima umana composta da un tipo più raffinato di atomo distribuito in tutto il corpo..
La teoria atomica cadde in declino nel Medioevo, ma fu ripresa all'inizio della rivoluzione scientifica nel XVII secolo..
Isaac Newton, ad esempio, credeva che la materia fosse costituita da "particelle solide, massicce, dure, impenetrabili e mobili"..
La divisibilità può avvenire con diversi metodi, il più comune è la divisibilità per metodi fisici, ad esempio tagliare una mela con un coltello.
Tuttavia, la divisibilità può anche verificarsi con metodi chimici in cui la materia sarebbe separata in molecole o atomi.
10 esempi di divisibilità chimica
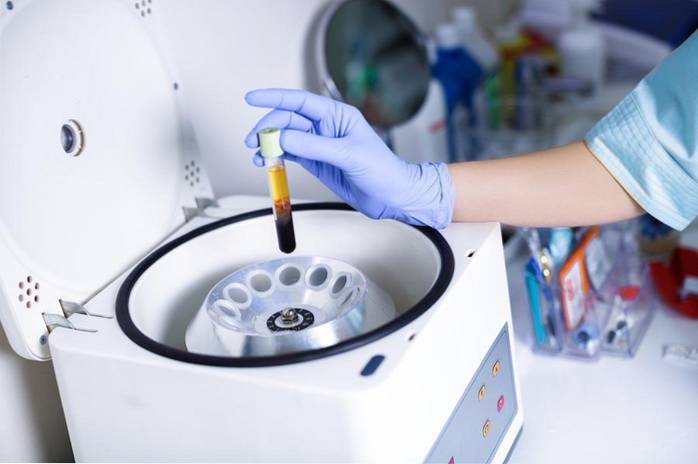
1- Sciogliere il sale nell'acqua
Quando un sale, ad esempio il cloruro di sodio, viene sciolto in acqua, si verifica un fenomeno di solvatazione dove i legami ionici del sale si rompono:
NaCl → Na+ + Cl-
Dissolvendo solo un granello di sale in acqua, si separerà in miliardi di ioni sodio e cloruro in soluzione..
2- Ossidazione dei metalli in un mezzo acido
Tutti i metalli, ad esempio il magnesio o lo zinco, reagiscono con gli acidi, ad esempio l'acido cloridrico diluito per dare bolle di idrogeno e una soluzione incolore del cloruro di metallo.
Mg + HCl → MgDue+ +Cl- + HDue
L'acido ossida il metallo, separando i legami metallici per ottenere ioni in soluzione (BBC, 2014).
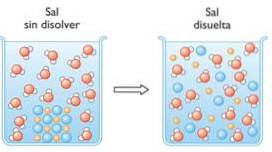
3- Idrolisi degli esteri
L'idrolisi è la rottura di un legame chimico attraverso l'acqua. Un esempio di idrolisi è l'idrolisi degli esteri dove questi sono divisi in due molecole, un alcol e un acido carbossilico..
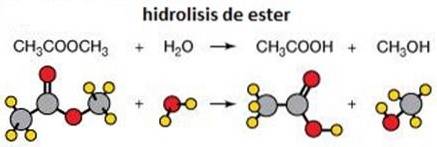
4- Reazioni di eliminazione
Una reazione di eliminazione fa esattamente quello che dice: rimuove gli atomi da una molecola. Questo viene fatto per creare un doppio legame carbonio-carbonio. Questo può essere fatto usando una base o un acido.
Può verificarsi in una singola fase concertata (l'astrazione del protone in Cα avviene contemporaneamente alla scissione del legame Cβ-X), o in due fasi (la scissione del legame Cβ-X avviene prima per formare un intermedio carbocatione, che poi "si spegne" per astrazione del protone nel carbonio alfa).
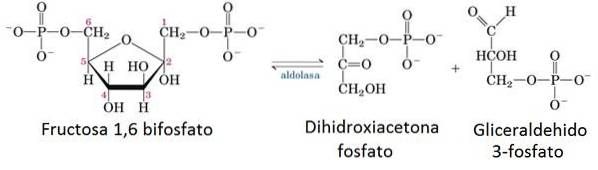
5- Reazione enzimatica dell'aldolasi
Nella fase preparativa della glicolisi, una molecola di glucosio viene suddivisa in due molecole di gliceraldeide 3-fosfato (G3P) utilizzando 2 ATP.
L'enzima responsabile di questa incisione è l'aldolasi, che per condensazione inversa divide in due la molecola di fruttosio 1,6-bisfosfato in una molecola G3P e una molecola di diidrossiacetone fosfato che successivamente viene isomerizzata per formare un'altra molecola di G3P.
6- Degradazione delle biomolecole
Non solo la glicolisi, ma tutta la degradazione delle biomolecole nelle reazioni di catabolismo sono esempi di divisibilità chimica.
Questo perché partono da grandi molecole come carboidrati, acidi grassi e proteine per produrre molecole più piccole come l'acetil CoA che entra nel ciclo di Krebs per produrre energia sotto forma di ATP.
7- Reazioni di combustione
Questo è un altro esempio di divisibilità chimica poiché molecole complesse come il propano o il butano reagiscono con l'ossigeno per produrre CO.Due e acqua:
C3H8 + 5ODue → 3CODue + 4HDueO
Si può dire che la degradazione delle biomolecole sia una reazione di combustione poiché i prodotti finali sono CODue e l'acqua, tuttavia queste vengono fornite in molte fasi con diversi intermediari.
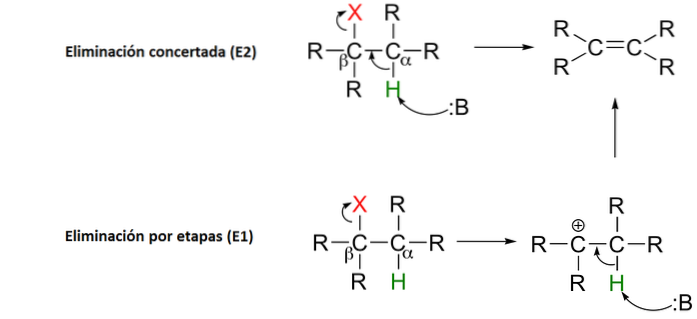
8- Centrifugazione del sangue
La separazione dei vari componenti del sangue è un esempio di divisibilità. Nonostante sia un processo fisico, l'esempio mi sembra interessante poiché i componenti sono separati per differenza di densità mediante centrifugazione.
I componenti più densi, il siero con i globuli rossi, rimarranno sul fondo della provetta da centrifuga mentre i componenti meno densi, il plasma, rimarranno in alto..
9- Tampone bicarbonato
Bicarbonato di sodio, HCO3- È il mezzo principale per il trasporto di CODue nel corpo prodotto delle reazioni di degradazione metabolica.
Questo composto reagisce con un protone nel mezzo per produrre acido carbonico che viene successivamente diviso in CO2 e acqua:
HCO3- + H+ D HDueCO3 D CODue + HDueO
Poiché le reazioni sono reversibili, questo è un modo che l'organismo ha, attraverso la respirazione, per controllare il pH fisiologico per evitare processi di alcalosi o acidosi.
10- Divisione dell'atomo o fissione nucleare
Nel caso in cui un nucleo massiccio (come l'uranio-235) si rompa (fissioni), si otterrà una resa energetica netta. Questo perché la somma delle masse dei frammenti sarà inferiore alla massa del nucleo di uranio..
Nel caso in cui la massa dei frammenti sia uguale o maggiore di quella del ferro al picco della curva di energia di legame, le particelle nucleari saranno più strettamente legate che nel nucleo di uranio e questa diminuzione di massa avviene in forma energetica secondo all'equazione di Einstein.
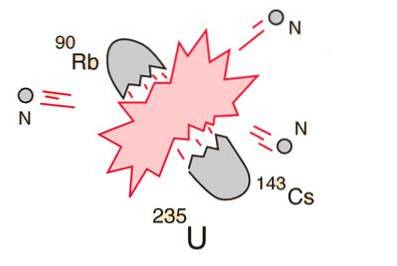
Per elementi più leggeri del ferro, la fusione produrrà energia. Questo concetto ha portato alla creazione della bomba atomica e dell'energia nucleare..
Riferimenti
- Software e multimedia di AJ. (2015). Fissione nucleare: nozioni di base. Recuperato da atomicarchive.com.
- (2014). Reazioni degli acidi. Recuperato da bbc.co.uk.
- Clark, J. (2016, gennaio). ESTERI IDROLIZZANTI. Recupero da chemguide.co.uk.
- Foist, L. (S.F.). Reazioni di eliminazione in chimica organica. Recupero da study.com.
- Miller, W. A. (1867). Elementi di chimica: teorica e pratica, parte 1. New York: John Wiley e figlio.
- Fissione nucleare. (S.F.). Recupero dall'iperfisica.
- Pratt, D. (1997, novembre). L'infinita divisibilità della materia. Recuperato da davidpratt.info.
- Soderberg, T. (2016, 31 maggio). Eliminazione da parte dei meccanismi E1 ed E2. Recuperato da chem.libretext.


Nessun utente ha ancora commentato questo articolo.