
Proprietà, produzione, usi del bicromato di sodio (Na2Cr2O7)

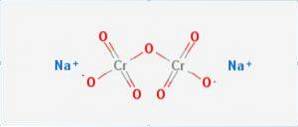
Il bicromato di sodio è un composto inorganico con la formula Na2Cr2O7. È uno dei tanti composti di cromo esavalente (Cr VI). La sua struttura è illustrata nella figura 1, sebbene il sale sia solitamente manipolato nella sua forma diidrata, la cui formula sarebbe Na2Cr2O7 · H2O.
Ha due legami ionici tra le molecole di sodio e l'ossigeno caricato negativamente. Il minerale di cromo viene estratto dal bicromato di sodio. Ogni anno vengono prodotti milioni di chilogrammi di bicromato di sodio.
La Cina è il maggior produttore di bicromato di sodio, tuttavia gli stabilimenti chimici cinesi hanno una produzione relativamente bassa, inferiore a 50.000 tonnellate all'anno ciascuno, rispetto allo stabilimento kazako che ne produce più di 100.000 tonnellate all'anno..
Gli stabilimenti in Russia, Stati Uniti e Regno Unito hanno una produzione intermedia compresa tra 50.000 e 100.000 tonnellate all'anno (Kogel, 2006).
In termini di reattività e aspetto, il bicromato di sodio ha proprietà simili al bicromato di potassio, tuttavia il sale di sodio è più solubile in acqua e ha un peso equivalente inferiore rispetto al sale di potassio..
Il bicromato di sodio produce fumi tossici di cromo quando riscaldato. È un forte agente ossidante ed è altamente corrosivo.
Questo composto può essere trovato in fonti di acqua potabile contaminata da diversi processi industriali come tecniche di galvanizzazione o galvanica, concia della pelle e produzione tessile..
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Metodi di produzione
- 3 Reattività e rischi
- 4 Usi e applicazioni
- 5 Biochimica
- 6 Riferimenti
Proprietà fisiche e chimiche
Il bicromato di sodio è composto da cristalli con una struttura monoclina di colore rosso-arancio nella loro forma anidra e inodore. Il suo peso molecolare è 261,97 g / mol nella sua forma anidra e 298,00 g / mol nella sua forma diidrata..
Ha un punto di fusione di 356,7 gradi Celsius, un punto di ebollizione di 400 gradi Celsius in cui si decompone. Ha una densità di 2,52 g / ml.

L'aspetto del bicromato di sodio è mostrato nella Figura 2. La sua solubilità in acqua è di 187 g per 100 grammi a 25 gradi Celsius e la sua solubilità in etanolo è di 513,2 grammi per litro a 19,4 gradi Celsius (National Center for Biotechnology Information, n.d.).
È considerato un composto stabile se conservato nelle condizioni raccomandate e non è infiammabile. Poiché è un forte agente ossidante, è corrosivo e in soluzione è acido che ha la capacità di abbassare il pH a 4 in una soluzione all'1% p / v..
Metodi di produzione
Il cromato di sodio può essere convertito in bicromato attraverso un processo continuo che si occupa di acido solforico, anidride carbonica o una combinazione di questi due..
L'evaporazione del liquido di bicromato di sodio provoca la precipitazione del solfato di sodio e / o del bicarbonato di sodio e questi composti vengono rimossi prima della cristallizzazione finale del bicromato di sodio..
Il bicromato di sodio può essere prodotto in un processo in tre fasi:
- Condizioni di ossidazione della cromite tostata alcalina
- Lisciviazione. Estrazione di sostanze solubili da una miscela mediante l'azione di un solvente liquido
- Conversione del monocromato di sodio in bicromato di sodio mediante un acido.
Il bicromato di sodio anidro può essere preparato fondendo bicromato di sodio diidrato, cristallizzando soluzioni acquose di bicromato sopra 86 gradi C o essiccando soluzioni di bicromato di sodio in essiccatori a spruzzo..
Le soluzioni di bicromato di sodio al 69 e 70% p / v sono utilizzate come metodo conveniente ed economico per le quantità di spedizione, evitando la necessità di manipolazione manuale o dissoluzione dei cristalli..
Reattività e rischi
È un forte agente ossidante. Incompatibile con acidi forti. Il contatto con materiali combustibili può provocare incendi. Fumi tossici di ossido di cromo possono formarsi in presenza di calore o fuoco.
La ben nota "miscela di acido cromico" di bicromato e acido solforico con residui organici dà luogo ad una violenta reazione esotermica. Questa miscela in combinazione con residui di acetone porta anche a una reazione violenta..
La combinazione di bicromato e acido solforico con alcoli, etanolo e 2-propanolo, dà luogo ad una violenta reazione esotermica. A causa del verificarsi di molti incidenti che coinvolgono la miscelazione di acido bicromato-solforico con materiali organici ossidabili, è probabilmente meglio evitare tali interazioni..
La combinazione di bicromato con idrazina è esplosiva, ci si può aspettare che la reazione del dicromato sia vigorosa con le ammine in generale. L'aggiunta del sale bicromato disidratato all'anidride acetica porta ad una reazione esotermica finalmente esplosiva..
Boro, silicio e bicromati formano miscele pirotecniche. Una miscela di acido acetico, 2-metil-2-pentenale e dicromato porta a una reazione dilagante (Chemical Datasheet Sodium Dichromate., 2016).
L'inalazione di polvere o nebbia provoca un'irritazione respiratoria che a volte assomiglia all'asma. Può verificarsi perforazione settale. È considerato veleno.
L'ingestione provoca vomito, diarrea e, molto insolitamente, complicazioni allo stomaco e ai reni. Il contatto con gli occhi o la pelle provoca irritazione locale. L'esposizione ripetuta della pelle provoca dermatiti.
Il bicromato di sodio è cancerogeno per l'uomo. Ci sono prove che il cromo esavalente o i composti di Cr (VI) possono causare il cancro ai polmoni negli esseri umani. È stato dimostrato che il bicromato di sodio causa il cancro ai polmoni negli animali.
Sebbene il bicromato di sodio non sia stato identificato come un composto a rischio teratogeno o riproduttivo, è noto che il cromo esavalente o i composti di Cr (VI) sono teratogeni e causano danni riproduttivi come la riduzione della fertilità e l'interferenza con i cicli mestruali..
Il bicromato di sodio può causare danni al fegato e ai reni, quindi deve essere maneggiato con estrema cura (New Jersey Department of Health, 2009).
In caso di ingestione, la vittima deve bere acqua o latte; non indurre mai il vomito. In caso di contatto con la pelle o gli occhi, deve essere trattato come ustioni da acido; sciacquare gli occhi con acqua per almeno 15 minuti.
Le lesioni esterne possono essere strofinate con una soluzione di tiosolfato di sodio al 2%. In tutti i casi dovrebbe essere consultato un medico.
Usi e applicazioni
A parte la sua importanza nella produzione di altri prodotti chimici al cromo, il bicromato di sodio ha anche molti usi diretti come ingrediente nella produzione di:
- Finitura metallica: aiuta la resistenza alla corrosione e pulisce le superfici metalliche, favorisce inoltre l'adesione della vernice.
- Prodotti biologici: utilizzati come agenti ossidanti nella fabbricazione di prodotti come la vitamina K e la cera.
- Pigmenti: utilizzati nella produzione di pigmenti cromati inorganici dove produce una gamma di colori stabili alla luce. Alcuni gradi di cromato sono anche usati come inibitori di corrosione in sottofondi e primer..
- Ceramica: utilizzata nella preparazione di vetri colorati e smalti ceramici.
- Tessuto: usato come mordente per coloranti acidi per potenziarne le proprietà coloranti veloci.
- Produzione di solfato di cromo.
(Bicromato di sodio. L'elemento costitutivo di praticamente tutti gli altri composti del cromo., 2010-2012)
Bicromato di sodio diidrato, ideale per l'uso in varie condizioni comprese le applicazioni ad alta temperatura come smalti ceramici e vetri colorati.
L'ossido cromico, essendo più duro di altri ossidi metallici, come il titanio o il ferro, è ideale per ambienti in cui la temperatura e le condizioni di processo sono aggressive.
Questa sostanza è utilizzata principalmente per produrre altri composti del cromo, ma è anche utilizzata nei fanghi di bentonite utilizzati nella produzione di petrolio, nei preservanti del legno, nella produzione di sostanze chimiche organiche e come inibitore della corrosione..
Quando miscelato con bicromato di potassio alluminio, utilizzando il processo termico dell'alluminio, l'ossido cromico produce cromo metallico di elevata purezza. Questo è un ingrediente fondamentale nella produzione delle superleghe ad alte prestazioni utilizzate nell'industria aerospaziale..
Nella sintesi organica, il bicromato di sodio viene utilizzato come agente ossidante nelle reazioni di riduzione dell'ossido in presenza di acido solforico..
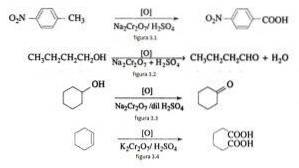
Ad esempio l'ossidazione di p nitrotoluene per formare acido p nitrobenzoico, nell'ossidazione di n-butanolo per formare n-butaldeide, nella formazione di cicloesanone da cicloesanolo e la formazione di acido adipico come illustrato nelle figure 3.1, 3.2, 3.3 e 3.4 rispettivamente (VK Ahluwalia, 2004).
Biochimica
L'instillazione intratracheale di bicromato di sodio (CrVI) e idrossido di acetato di cromo (CrIII) nei ratti maschi ha determinato un aumento delle concentrazioni di cromo nel sangue intero, plasma e urina fino a 72 ore dopo l'esposizione; Le concentrazioni massime sono state raggiunte 6 ore dopo l'esposizione..
Il rapporto tra le concentrazioni di cromo nel sangue intero e le concentrazioni di cromo plasmatico era significativamente diverso per i trattamenti Cr (VI) e Cr (III). Pertanto, per la valutazione dell'esposizione al cromo devono essere utilizzati i test del cromo nel sangue e del cromo plasmatico..
Il cromo è stato rilevato anche nei linfociti periferici. Cr (VI), ma non Cr (III) si è accumulato in modo significativo nei linfociti dopo il trattamento. Queste cellule hanno il potenziale per essere utilizzate come biomarcatori nella valutazione dell'esposizione ai composti del cromo (Hooth, 2008).
Riferimenti
- Scheda tecnica chimica bicromato di sodio. (2016). Estratto da sostanze chimiche cameo: cameochemicals.noaa.
- Hooth, M. J. (2008). Relazione tecnica sugli studi di tossicologia e cancerogenesi del bicromato di sodio diidrato. National Institute of Health USA.
- Kogel, J. E. (2006). Minerali e rocce industriali: materie prime, mercati e usi Settima edizione. littleton colorado: society of mining, metallurgyc and exploration inc.
- Centro nazionale per le informazioni sulla biotecnologia. (s.f.). Database composto di PubChem; CID = 25408. Estratto da pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Dipartimento della Salute del New Jersey. (2009, novembre). scheda informativa sulla sostanza pericolosa bicromato di sodio. Estratto da nj.gov: nj.gov.
- Bicromato di sodio. Il mattone per virtualmente tutti gli altri composti del cromo. (2010-2012). Estratto da elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Chimica organica pratica completa: preparazioni e analisi quantitative. Delhi: University press (India).


Nessun utente ha ancora commentato questo articolo.