
Struttura, proprietà, usi, rischi del nitrobenzene (C6H5NO2)
Il nitrobenzene è un composto organico aromatico formato da un anello benzenico C6H5- e un gruppo nitro -NODue. La sua formula chimica è C6H5NONDue. È un liquido oleoso incolore o giallo pallido, profumato di mandorle amare o lucido da scarpe..
Il nitrobenzene è un composto molto utile nell'industria chimica perché permette di ottenere una serie di sostanze chimiche che hanno vari usi. Questo perché può essere soggetto a vari tipi di reazioni.
Le reazioni chimiche importanti includono la nitrazione (che consente di aggiungere più gruppi -NODue alla molecola) e riduzione (l'opposto dell'ossidazione poiché i due atomi di ossigeno del gruppo nitro -NO vengono eliminatiDue e sono sostituiti da idrogeni).
Con nitrobenzene si possono preparare ad esempio anilina e para-acetaminofenolo. Quest'ultimo è il noto paracetamolo che è un antipiretico (medicinale contro la febbre) e un blando analgesico (medicinale contro il dolore minore)..
Il nitrobenzene deve essere maneggiato con cautela in quanto è irritante e tossico, può causare un tipo di anemia, tra diversi sintomi, e si ritiene che provochi il cancro. Inoltre è dannoso per l'ambiente.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Punto di ebollizione
- 3.5 Punto di infiammabilità
- 3.6 Temperatura di autoaccensione
- 3.7 Densità
- 3.8 Solubilità
- 3.9 Proprietà chimiche
- 3.10 Formazione di dimeri
- 3.11 Altre proprietà
- 4 Ottenimento
- 5 Usi
- 5.1 Per ottenere anilina e paracetamolo
- 5.2 Nell'ottenere altri composti chimici
- 5.3 In varie applicazioni
- 6 Rischi
- 7 Trattamenti per la sua eliminazione dall'ambiente
- 8 Riferimenti
Struttura
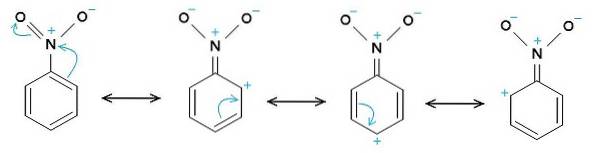
Nitrobenzene C6H5-NONDue è una molecola piatta formata da un anello benzenico C6H5- a cui è associato un gruppo nitro -NODue. La sua molecola è piatta perché c'è un'interazione elettronica tra il gruppo nitro -NODue e l'anello benzenico.
Il gruppo nitro -NODue tende ad attrarre elettroni dall'anello benzenico C6H5-.
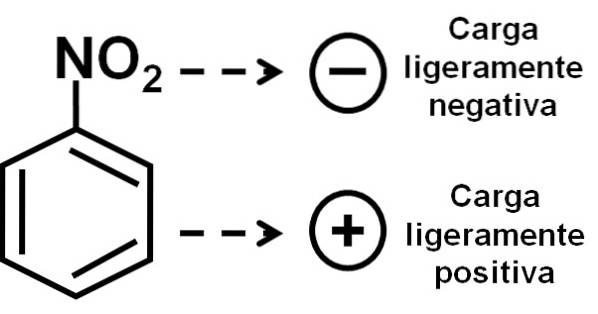
Pertanto, la molecola ha un lato leggermente più negativo (dove gli ossigeni di -NODue) e un lato leggermente più positivo (l'anello benzenico).
Nomenclatura
- Nitrobenzene.
- Nitrobenzina.
- Nitrobenzolo.
- Olio o essenza di Myrban o Myrban (termine in disuso).
Proprietà
Stato fisico
Liquido oleoso da incolore a giallo pallido.
Peso molecolare
123,11 g / mol.
Punto di fusione
5,7 ºC.
Punto di ebollizione
211 ºC.
Punto d'infiammabilità
88 ºC (metodo a vaso chiuso).
Temperatura di autoaccensione
480 ° C.
Densità
1.2037 g / cm3 a 20 ºC.
Solubilità
Leggermente solubile in acqua: 0,19 g / 100 g di acqua a 20 ° C. Completamente miscibile con alcool, benzene ed etere dietilico.
Proprietà chimiche
Il nitrobenzene è stabile fino a una temperatura di circa 450 ° C alla quale inizia a decomporsi formando (in assenza di ossigeno) NO, NODue, benzene, bifenile, anilina, dibenzofurano e naftalene.
Importanti reazioni del nitrobenzene includono riduzione, nitrazione, alogenazione e solfonazione..
La nitrazione del nitrobenzene produce inizialmente metha-nitrobenzene e con un tempo di reazione prolungato si ottiene 1,3,5-nitrobenzene.
Reagendo bromo o cloro con nitrobenzene in presenza di un catalizzatore appropriato, si ottiene 3-bromo-nitrobenzene (meta-bromonitrobenzene) o 3-cloro-nitrobenzene (meta-cloronitrobenzene)..
Un esempio di riduzione è che trattando con stagno (Sn) in acido cloridrico (HCl) i meta-alogenonitrobenzeni si ottengono le meta-alogenoaniline.
La nitrobenzensolfonazione viene effettuata con acido solforico fumante a 70-80 ° C e il prodotto è acido meta-nitrobenzensolfonico. Questo può essere ridotto con ferro e HCl per dare acido metanilico..
Formazione di dimeri
In una soluzione di benzene C6H6 le molecole di nitrobenzene si associano tra loro per formare dimeri o coppie di molecole. In queste coppie, una delle molecole è in una posizione invertita rispetto all'altra..
La formazione di dimeri di nitrobenzene con molecole una in posizione capovolta rispetto all'altra è forse dovuta al fatto che ciascuno di essi ha un lato leggermente più caricato positivamente e un lato opposto con una carica leggermente più negativa..
Nel dimero, il lato con una carica leggermente più positiva di una delle molecole si trova possibilmente vicino alla carica leggermente negativa dell'altra molecola, poiché le cariche opposte si attraggono, e questo è il caso degli altri due lati..
Altre proprietà
Ha un odore simile alle mandorle o al lucido da scarpe. Quando si abbassa la temperatura si solidifica sotto forma di cristalli giallo verdastri.
Ottenere
Ottenuto trattando il benzene C6H6 con una miscela di acido nitrico HNO3 e acido solforico HDueSW4. Il processo si chiama nitrazione e prevede la formazione dello ione nitronio NODue+ grazie alla presenza di acido solforico HDueSW4.
- Formazione NO di ioni nitronioDue+:
HNO3 + 2 hDueSW4 ⇔ H3O+ + 2 HSO4- + NONDue+ (ione nitronio)
- Lo ione nitronio attacca il benzene:
C6H6 + NONDue+ → C6H6NONDue+
- Il nitrobenzene si forma:
C6H6NONDue+ + HSO4- → C6H5NONDue + HDueSW4
In sintesi:
C6H6 + HNO3 → C6H5NONDue + HDueO
La reazione di nitrazione del benzene è molto esotermica, cioè viene generato molto calore, quindi è molto pericoloso.
Applicazioni
Nell'ottenere anilina e paracetamolo
Il nitrobenzene viene utilizzato principalmente per sintetizzare l'anilina C.6H5NHDue, che è un composto ampiamente utilizzato per la preparazione di pesticidi, gomme, coloranti, esplosivi e medicinali.
L'ottenimento dell'anilina avviene riducendo il nitrobenzene in un mezzo acido in presenza di ferro o stagno, che viene effettuata secondo le seguenti fasi:
Nitrobenzene → Nitrosobenzene → Fenilidrossilammina → Anilina
C6H5NONDue → C6H5NO → C6H5NHOH → C6H5NHDue

A seconda delle condizioni, il processo può essere interrotto in una delle fasi intermedie, ad esempio fenilidrossilammina. Partendo dalla fenilidrossilammina in mezzo fortemente acido, il para-amminofenolo può essere preparato:
Fenilidrossilammina → p-Aminofenolo
C6H5NHOH → HOC6H4NHDue
Quest'ultimo viene trattato con anidride acetica per ottenere il paracetamolo (acetaminofene), un noto antipiretico e blando analgesico, cioè un medicinale per curare febbre e dolore..
Un altro modo per ottenere l'anilina è ridurre il nitrobenzene con monossido di carbonio (CO) in un mezzo acquoso in presenza di particelle molto piccole (nanoparticelle) di palladio (Pd) come catalizzatore..
C6H5-NONDue + 3 CO + HDueO → C6H5-NHDue + 3 CODue
Nell'ottenere altri composti chimici
Il nitrobenzene è il punto di partenza per ottenere una grande varietà di composti usati come coloranti, pesticidi, medicinali e cosmetici.

Ad esempio, consente di ottenere 1,3-dinitrobenzene, che per clorazione (aggiunta di cloro) e riduzione (eliminazione degli atomi di ossigeno) genera 3-cloroanilina. Questo è usato come intermedio per pesticidi, coloranti e medicinali.
Il nitrobenzene è stato utilizzato per preparare la benzidina che è un colorante. Inoltre, il nitrobenzene viene utilizzato per preparare chinolina, azobenzene, acido metanilico, dinitrobenzene, isocianati o pirossilina tra molti altri composti..
In varie applicazioni
Il nitrobenzene viene utilizzato o è stato utilizzato come:
- Solvente di estrazione per la purificazione degli oli lubrificanti utilizzati nei macchinari
- Solvente per eteri di cellulosa
- Ingrediente della miscela per lucidare i metalli
- In saponi
- Nelle miscele per lucidare le scarpe
- Conservante per vernice spray
- Componente di miscele lucidanti per pavimenti
- Sostituto dell'essenza di mandorle
- Nell'industria dei profumi
- Nella produzione di gomma sintetica
- Solvente in vari processi

Rischi
Il nitrobenzene è tossico per inalazione, ingestione e assorbimento attraverso la pelle..
Irritante per la pelle, gli occhi e le vie respiratorie. Può causare un tipo di anemia chiamata metaemoglobinemia, che comporta una riduzione della capacità dei globuli rossi di rilasciare ossigeno nei tessuti e porta alla fatica..
Inoltre, il nitrobenzene causa dispnea, vertigini, disturbi della vista, mancanza di respiro, collasso e morte. Inoltre danneggia il fegato, la milza, i reni e il sistema nervoso centrale.
Si stima che possa essere un mutageno e possibilmente causare il cancro negli esseri umani, poiché lo ha causato negli animali.
Inoltre il nitrobenzene non deve essere smaltito nell'ambiente. La sua tossicità verso animali, piante e microrganismi lo rende molto dannoso per gli ecosistemi.
La tossicità nei confronti dei microrganismi riduce la loro biodegradabilità.
Trattamenti per la sua eliminazione dall'ambiente
La contaminazione dell'ambiente con il nitrobenzene può avvenire attraverso i rifiuti delle varie industrie che lo utilizzano, come l'industria dei coloranti o degli esplosivi..
Il nitrobenzene è un inquinante altamente tossico e difficile da decomporre in condizioni naturali, per questo motivo può causare gravi contaminazioni dell'acqua potabile e dei sistemi di irrigazione delle colture..
A causa della sua elevata stabilità e tossicità nei confronti dei microrganismi, è spesso selezionato come modello negli studi sul trattamento delle acque reflue..
Sono allo studio vari modi per rimuovere il nitrobenzene dall'acqua contaminata. Uno di questi è attraverso la degradazione fotocatalitica, cioè utilizzando la luce solare come acceleratore della reazione di degradazione in presenza di biossido di titanio TiODue.

Anche i metodi di microelettrolisi con un catalizzatore di ferro (Fe) e rame (Cu) in ceramica sono stati testati con successo. La microelettrolisi consente al nitrobenzene di essere scomposto da una corrente elettrica.
Riferimenti
- NOI. Biblioteca nazionale di medicina. (2019). Nitrobenzene. Recupero da pubchem.ncbi.nlm.nih.gov.
- Morrison, R.T. e Boyd, R.N. (2002). Chimica organica. 6a edizione. Prentice-Hall.
- Moldoveanu, S.C. (2019). Pirolisi di altri composti contenenti azoto. In Pyrolysis of Organic Molecules (seconda edizione). Recupero da sciencedirect.com.
- Smith, P.W.G. et al. (1969). Nitrazione aromatica-composti nitro. Sostituzioni elettrofile. In chimica aromatica. Recupero da sciencedirect.com.
- Windholz, M. et al. (editori) (1983). L'indice Merck. Un'enciclopedia di prodotti chimici, farmaci e biologici. Decima edizione. Merck & CO., Inc.
- Enciclopedia della chimica industriale di Ullmann. (1990). Quinta edizione. Volume A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. et al. (2012). Degradazione fotocatalitica irradiata dai raggi UV del nitrobenzene per legame di titania su tubo di quarzo. International Journal of Photoenergy, Volume 2012, ID articolo 681941. Recupero da hindawi.com.
- Shikata, T. et al. (2014). Formazione di dimeri antiparalleli di nitrobenzene in solventi non polari. AIP Advances 4, 067130 (2014). Recuperato da doaj.org.
- Krogul-Sobczak, A. et al. (2019). Riduzione del nitrobenzene ad anilina di CO / HDueO in presenza di nanoparticelle di palladio. Catalysts 2019, 9, 404. Recuperato da mdpi.com.
- Yang, B. et al. (2019). Produzione su scala pilota, proprietà e applicazione del riempitivo ceramico catalitico Fe / Cu per il trattamento delle acque reflue di composti di nitrobenzene. Catalysts 2019, 9, 11. Recuperato da mdpi.com.

Nessun utente ha ancora commentato questo articolo.