
Proprietà di dibenzalacetone, meccanismo di reazione, usi, rischi
Il dibenzalacetone (dba) è un composto organico la cui formula molecolare è C17H14O. È un solido giallastro che, a seconda della sua purezza, può apparire come cristalli. Viene utilizzato nelle creme solari e nelle sintesi organometalliche in cui il palladio viene utilizzato come catalizzatore.
Sebbene la sua sintesi sia un processo relativamente semplice, abbastanza ricorrente nei laboratori didattici per spiegare la condensazione aldolica, il suo meccanismo è alquanto esteso e devono essere presi in considerazione diversi fattori. La benzaldeide utilizzata, che si condenserà con l'acetone, deve essere distillata di fresco per garantire la sua bassa ossidazione a contatto con l'aria..

Allo stesso modo, un mezzo etanolo-acqua basico viene utilizzato per solubilizzare i reagenti e, allo stesso tempo, promuovere la precipitazione finale del dibenzalacetone, un composto idrofobo e insolubile. Finora non è noto quali effetti negativi possa avere il dibenzalacetone sul corpo o sull'ambiente, oltre a quello di essere una sostanza irritante.
Indice articolo
- 1 Proprietà
- 1.1 Aspetto fisico
- 1.2 Massa molare
- 1.3 Isomeri
- 1.4 Punto di fusione
- 1.5 Solubilità in acqua
- 1.6 Struttura
- 2 Meccanismo di reazione del dibenzalacetone
- 3 Sintesi
- 3.1 Reagenti
- 3.2 Procedura
- 3.3 Ricristallizzazione
- 4 Usi
- 5 Rischi
- 6 Riferimenti
Proprietà
Aspetto fisico
Solido giallastro polveroso o dall'aspetto cristallino.
Massa molare
234,29 g / mol
Isomeri
Il dibenzalacetone si presenta come tre isomeri geometrici: trans-trans, trans-cis e cis-cis. L'isomero trans-trans è il più stabile di tutti e, quindi, quello più prodotto durante la sintesi.
Punto di fusione
110-111 ° C. Questo intervallo varia a seconda del grado di purezza del solido sintetizzato..
Solubilità dell'acqua
Insolubile.
Struttura
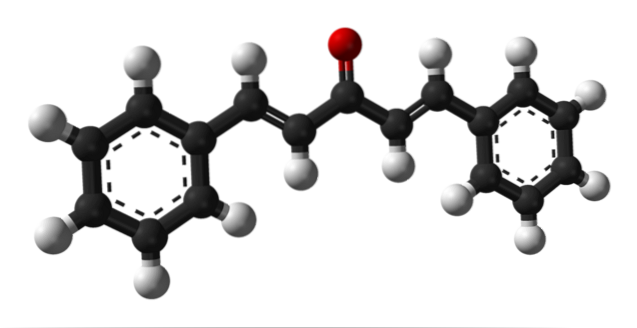
L'immagine in alto mostra la molecola dell'isomero trans-trans dibenzalacetone, rappresentata da un modello di sfere e barre. Al centro abbiamo il gruppo carbonile e ai suoi lati alcuni doppi legami e due anelli benzenici aromatici.
Il dibenzalacetone è essenzialmente apolare e idrofobo, poiché la sua intera struttura è praticamente composta da atomi di carbonio e idrogeni. Il gruppo carbonile gli dà solo un piccolo momento di dipolo.
La struttura può essere paragonata a quella di una foglia, poiché tutti i suoi atomi di carbonio hanno ibridazione spDue; quindi, riposano sullo stesso piano.
I fotoni di luce interagiscono con il sistema π-coniugato del dibenzalacetone; specialmente quelli della radiazione UV, essendo assorbiti per eccitare gli elettroni delocalizzati. Questa proprietà rende il dibenzalacetone un eccellente assorbitore della luce ultravioletta..
Meccanismo di reazione del dibenzalacetone
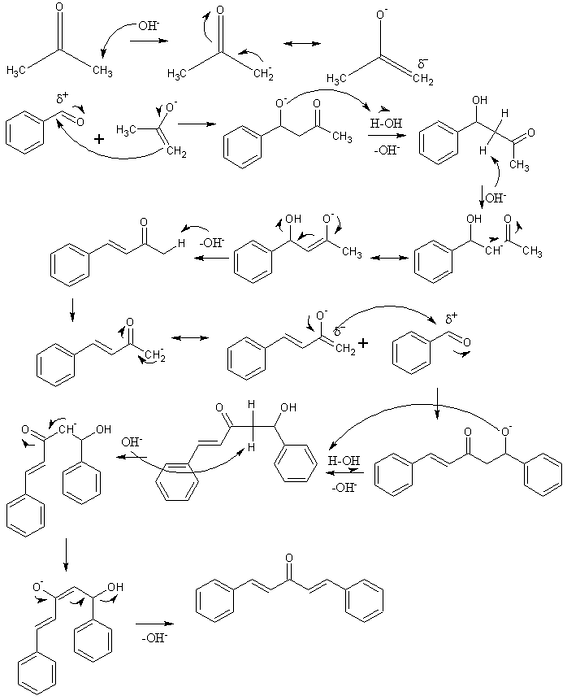
Nell'immagine in alto abbiamo rappresentato il meccanismo della condensazione aldolica tra benzaldeide e acetone, da cui origina il dibenzalacetone; in particolare, il suo isomero trans-trans.
La reazione inizia con l'acetone in un mezzo basico. L'OH- deprotona un protone acido di uno dei suoi due gruppi metilici, -CH3, dando origine ad un enolato: CH3C (O) CHDue-, che delocalizza la sua carica negativa per risonanza (prima riga dell'immagine).
Questo enolato agisce quindi come un agente nucleofilo: attacca il gruppo carbonile di una molecola di benzaldeide. La sua incorporazione nella benzaldeide genera un alcossido che, essendo molto basico, deprotona una molecola d'acqua e diventa un aldolo (seconda fila). L'aldolo o β-idrossichetone è caratterizzato dall'avere i gruppi C = O e OH.
Il mezzo di base disidrata questo aldolo e nella sua struttura si forma un doppio legame, che genera benzilideneacetone (terza fila). Successivamente, l'OH- deprotona anche uno dei suoi idrogeni acidi, ripetendo un altro attacco nucleofilo su una seconda molecola di benzaldeide. Questa volta l'attacco avviene a velocità più lenta (quarta fila).
Il prodotto formato deprotona un'altra molecola d'acqua e subisce nuovamente la disidratazione per eliminare il gruppo OH e stabilire un secondo doppio legame (quinta e sesta fila). Così e infine, viene prodotto dibenzalacetone.
Sintesi
Reagenti
I reagenti per effettuare la sintesi del dibenzalacetone sono i seguenti:
- Etanolo al 95%.
- Benzaldeide appena distillata dall'olio di mandorle amare.
- NaOH come catalizzatore di base in acqua distillata.
Le quantità da utilizzare dipendono dalla quantità di dibenzalacetone da sintetizzare. Tuttavia, si cerca che ci sia un eccesso di benzaldeide, perché una parte di essa è ossidata in acido benzoico. È anche garantito che la reazione richiede meno tempo e che l'indesiderabile benzilidenacetone viene prodotto in misura minore..
L'etanolo agisce come un solvente per la benzaldeide, altrimenti non si dissolverebbe nel mezzo NaOH basico.
Processi
In un grande becher, mescolare l'etanolo con la benzaldeide. Quindi il mezzo NaOH di base viene aggiunto durante l'agitazione magnetica costante. In questa fase, la reazione di Cannizzaro avviene in misura minore; cioè due molecole di benzaldeide sproporzionate in una di alcool benzilico e l'altra di acido benzoico, facilmente riconoscibili dal suo caratteristico odore dolce.
Infine si aggiunge l'acetone e si attende mezz'ora che la soluzione diventi torbida e di colore giallo-arancio. Il dibenzalacetone precipiterà a causa dell'acqua, quindi viene aggiunto un volume considerevole di acqua per favorirne la completa precipitazione..
Il dibenzalacetone viene filtrato sotto vuoto e il suo solido giallastro viene lavato più volte con acqua distillata..
Ricristallizzazione

Per purificare il dibenzalacetone si usa etanolo al 95% o acetato di etile caldo, così da ottenere cristalli di maggiore purezza ogni volta che si ripete la ricristallizzazione. Pertanto, la polvere giallastra iniziale sarà trasformata in piccoli cristalli gialli di dibenzalacetone..
Applicazioni
Il dibenzalacetone è un composto che non ha molti usi. Grazie alla sua capacità di assorbire la luce ultravioletta, viene utilizzato nella formulazione di creme solari, o qualsiasi altro prodotto che cerchi di mitigare l'incidenza dei raggi UV, siano essi rivestimenti o vernici..
D'altra parte, il dibenzalacetone è utilizzato nelle sintesi organometalliche del palladio. Agisce come un legante che si coordina con gli atomi di palladio metallico, Pd0, per formare il complesso tris (dibenzilideneacetone) dipalladio (0).
Questo composto organometallico fornisce atomi di Pd0 in diverse sintesi organiche, quindi si comporta come un catalizzatore omogeneo, poiché si dissolve in molti solventi organici.
Inoltre, il dibenzalacetone come legante è facile da sostituire con altri leganti organici, il che consente alle sintesi organometalliche del palladio di svilupparsi rapidamente..
Rischi
Per quanto riguarda i rischi, non sono disponibili molte informazioni che riportino i possibili impatti sulla salute o sull'ambiente che il dibenzalacetone può causare. Allo stato puro, è un irritante solido per ingestione, respirazione o contatto diretto con gli occhi o la pelle..
Tuttavia, a quanto pare non è abbastanza irritante da non poter far parte delle formulazioni per la protezione solare. D'altra parte, essendo così insolubile in acqua, la sua concentrazione in essa è trascurabile, presentandosi come un contaminante solido. In questo senso, non si sa quanto sia dannosa la torbidità che provoca per la fauna o il suolo marino..
Fino a prova contraria, il dibenzalacetone sarà considerato un composto relativamente sicuro, poiché la sua bassa reattività non è motivo di rischio o di maggiori precauzioni..
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. (10a edizione.). Wiley plus.
- Wikipedia. (2020). Dibenzylideneacetone. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Dibenzylideneacetone. Database PubChem., CID = 640180. Estratto da: pubchem.ncbi.nlm.nih.gov
- Sintesi organiche. (2020). Dibenzalacetone. Recupero da: orgsyn.org
- Dibenzalacetone di Aldol Condensation. Recupero da: web.mnstate.edu



Nessun utente ha ancora commentato questo articolo.