
Curva di riscaldamento cos'è, come si fa, esempi
UN curva di riscaldamento è la rappresentazione grafica di come varia la temperatura di un campione in funzione del tempo, mantenendo la pressione costante e aggiungendo calore in modo uniforme, cioè a velocità costante.
Per costruire un grafico di questo tipo si prendono coppie di valori di temperatura e tempo, che vengono successivamente rappresentati graficamente ponendo la temperatura sull'asse verticale (ordinate) e il tempo sull'asse orizzontale (ascisse).

Quindi la curva più appropriata viene adattata a questi punti sperimentali e infine si ottiene un grafico della temperatura T in funzione del tempo t: T (t).
Indice articolo
- 1 Qual è la curva di riscaldamento?
- 1.1 -Cambiamento di stato in una sostanza
- 2 Come si crea una curva di riscaldamento?
- 3 esempi (acqua, ferro ...)
- 3.1 Sciogliere il ghiaccio
- 3.2 Conversione dell'acqua in vapore
- 4 Riferimenti
Qual è la curva di riscaldamento?
Quando viene riscaldata, una sostanza attraversa diversi stati in successione: da solida può diventare vapore, passando quasi sempre per lo stato liquido. Questi processi sono chiamati cambiamenti di stato, in cui il campione aumenta la sua energia interna mentre viene aggiunto calore, come indicato dalla teoria cinetica molecolare..
Quando si aggiunge calore a un campione ci sono due possibilità:
- La sostanza aumenta la sua temperatura, poiché le sue particelle vengono agitate con maggiore intensità.
- Il materiale sta subendo un cambio di fase, in cui la temperatura rimane costante. L'aggiunta di calore ha l'effetto di indebolire in una certa misura le forze che tengono insieme le particelle, quindi è facile passare dal ghiaccio all'acqua liquida, per esempio.
La figura 2 mostra i quattro stati della materia: solido, liquido, gas e plasma, ei nomi dei processi che consentono la transizione tra di loro. Le frecce indicano la direzione del processo.
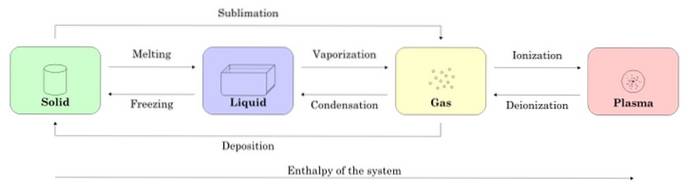
-Cambiamenti di stato in una sostanza
Partendo da un campione allo stato solido, quando fonde passa allo stato liquido, quando vaporizza si trasforma in gas e per ionizzazione si trasforma in plasma.
Il solido può essere convertito direttamente in gas mediante il processo noto come sublimazione. Esistono sostanze che sublimano facilmente a temperatura ambiente. Il più noto è il CODue o ghiaccio secco, nonché naftalene e iodio.
Mentre il campione subisce un cambiamento di stato, la temperatura rimane costante fino a quando non viene raggiunto il nuovo stato. Ciò significa che se, ad esempio, hai una porzione di acqua liquida che ha raggiunto il punto di ebollizione, la sua temperatura rimane costante fino a quando tutta l'acqua non si è trasformata in vapore..
Per questo motivo, la curva di riscaldamento dovrebbe essere composta da una combinazione di sezioni crescenti e sezioni orizzontali, dove queste ultime corrispondono a cambiamenti di fase. La figura 3 mostra una di queste curve per una data sostanza.
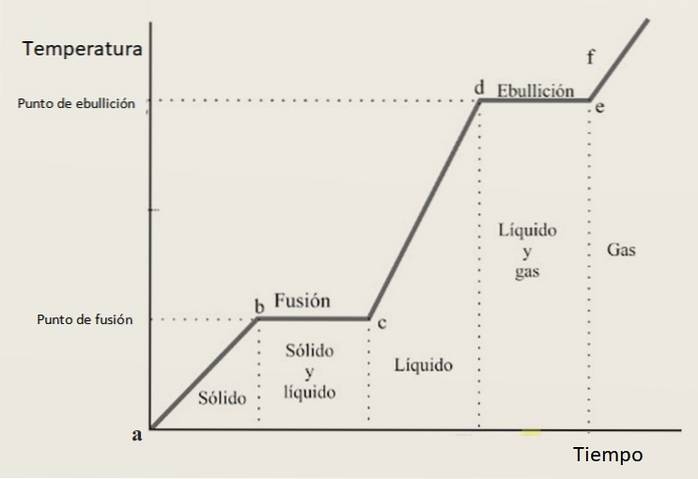
Interpretazione della curva di riscaldamento
Negli intervalli di crescita ab, CD Y ef la sostanza si trova rispettivamente come un solido, un liquido e un gas. In queste regioni l'energia cinetica aumenta e con essa la temperatura.
nel frattempo a avanti Cristo sta cambiando il suo stato da solido a liquido, quindi le due fasi coesistono. Ecco come accade nella sezione a partire dal, in cui il campione cambia da liquido a gas. Qui l'energia potenziale sta cambiando e la temperatura rimane costante.
È possibile anche la procedura inversa, ovvero il campione può essere raffreddato per adottare successivamente altri stati. In tal caso parliamo di curva di raffreddamento.
Le curve di riscaldamento hanno lo stesso aspetto generale per tutte le sostanze, anche se ovviamente non gli stessi valori numerici. Alcune sostanze impiegano più tempo di altre per cambiare stato e si sciolgono e vaporizzano a temperature diverse..
Questi punti sono noti rispettivamente come punto di fusione e punto di ebollizione e sono caratteristiche di ciascuna sostanza..
Ecco perché le curve di riscaldamento sono molto utili, poiché indicano il valore numerico di queste temperature per milioni di sostanze che esistono come solidi e liquidi nell'intervallo di temperature considerate normali e alla pressione atmosferica..
Come fai una curva di riscaldamento?
In linea di principio, è molto semplice: è sufficiente posizionare un campione della sostanza in un contenitore dotato di agitatore, inserire un termometro e riscaldare in modo uniforme..
Contemporaneamente, all'avvio della procedura, viene attivato un cronometro e di volta in volta vengono annotate le corrispondenti coppie temperatura-tempo..
La fonte di calore può essere un bruciatore a gas, con una buona velocità di riscaldamento, oppure una resistenza elettrica che emette calore quando riscaldata, che può essere collegata ad una fonte variabile per ottenere potenze diverse..
Per una maggiore precisione esistono due tecniche ampiamente utilizzate nel laboratorio di chimica:
- Analisi termica differenziale.
- Calorimetria differenziale a scansione.
Confrontano la differenza di temperatura tra il campione in esame e un altro campione di riferimento con una temperatura di fusione elevata, quasi sempre un ossido di alluminio. Con questi metodi è facile trovare i punti di fusione e di ebollizione.
Esempi (acqua, ferro ...)
Considera le curve di riscaldamento per l'acqua e per il ferro mostrate in figura. La scala temporale non è mostrata, tuttavia è immediato distinguere le temperature di fusione per entrambe le sostanze che corrispondono al punto B di ogni grafico: per acqua 0 º C, per ferro 1500 º C.
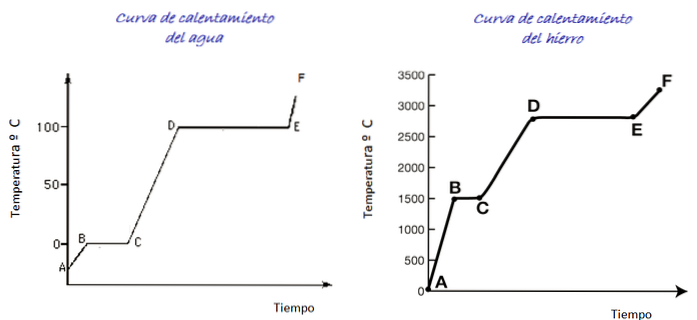
L'acqua è una sostanza universale e l'intervallo di temperature necessario per vederne i cambiamenti di stato è facilmente raggiungibile in laboratorio. Per il ferro sono necessarie temperature molto più elevate, ma come notato sopra, la forma del grafico non cambia sostanzialmente..
Sciogliendo il ghiaccio
Quando si riscalda il campione di ghiaccio, secondo il grafico siamo al punto A, ad una temperatura inferiore a 0º C. Si osserva che la temperatura aumenta ad una velocità costante fino a raggiungere 0º C.
Le molecole d'acqua all'interno del ghiaccio vibrano con maggiore ampiezza. Una volta raggiunta la temperatura di fusione (punto B), le molecole possono già muoversi una di fronte all'altra.
L'energia che arriva viene investita nel ridurre la forza di attrazione tra le molecole, quindi la temperatura tra B e C rimane costante fino a quando tutto il ghiaccio si è sciolto..
Trasformare l'acqua in vapore
Una volta che l'acqua è completamente allo stato liquido, la vibrazione delle molecole aumenta di nuovo e la temperatura aumenta rapidamente tra C e D fino al punto di ebollizione di 100 ° C. Tra D ed E la temperatura rimane a quel valore mentre l'energia che arriva assicura che tutta l'acqua nel contenitore evapori.
Se tutto il vapore acqueo può essere contenuto in un contenitore, si può continuare a riscaldare dal punto E al punto F, il cui limite non è mostrato nel grafico..
Un campione di ferro può subire queste stesse modifiche. Tuttavia, data la natura del materiale, gli intervalli di temperatura sono molto diversi..
Riferimenti
- Atkins, P. Principles of Chemistry: The Paths of Discovery. Editoriale Médica Panamericana. 219-221.
- Chung, P. Curve di riscaldamento. Recupero da: chem.libretexts.org.
- Curve di riscaldamento. Calore di fusione e vaporizzazione. Estratto da: wikipremed.com.
- Hewitt, Paul. 2012. Scienze fisiche concettuali. 5 °. Ed. Pearson. 174-180.
- Università di Valladolid. Laurea in Chimica, Recupero da: accommodation.uva.es.

Nessun utente ha ancora commentato questo articolo.