
Caratteristiche, tipi, applicazioni, esempi dei colloidi
Il colloidi Sono miscele in cui vengono distribuite minuscole particelle insolubili (chiamate fase dispersa) sospese in un mezzo disperdente continuo (o fase fluida). Le particelle della fase dispersa, come quelle della fase disperdente, possono essere di natura gassosa, liquida o solida..
Esempi di colloidi includono la nebbia, dove il mezzo disperdente è l'aria e la fase dispersa è costituita da goccioline d'acqua microscopiche. Un caso ovvio sarebbe un succo, il mezzo disperdente è l'acqua e la fase disperdente i minerali, le vitamine, gli idrati, ecc..

Il raggio delle particelle di fase disperse è compreso tra 0,001 µm e 0,1 µm (1 nm a 1000 nm). Questo raggio è così piccolo che la sua sedimentazione è molto bassa, motivo per cui i colloidi sono considerati miscele stabili; sebbene di solito abbiano un aspetto torbido.
I colloidi hanno una serie di caratteristiche proprie, come l'effetto Tyndall. Ciò consiste nel fatto che le particelle della fase dispersa sono in grado di diffondere la luce in tutte le direzioni..
I colloidi, a causa della loro affinità per l'acqua, sono classificati come idrofili e idrofobi. Inoltre, di questi, esiste la seguente classificazione per loro: emulsione, emulsione solida, sol, gel, schiuma, schiuma solida, aerosol liquido e aerosol solido.
Indice articolo
- 1 Caratteristiche dei colloidi
- 1.1 Composizione
- 1.2 Adsorbimento
- 1.3 Elettroforesi
- 1.4 Dialisi
- 1.5 Moto browniano
- 1.6 Effetto Tyndall
- 2 tipi di colloidi
- 2.1 Emulsione
- 2.2 Emulsione solida
- 2.3 Schiuma
- 2.4 Schiuma solida
- 2.5 Soli e gel
- 2.6 Aerosol liquido
- 2.7 Aerosol solido
- 3 Applicazioni
- 3.1 Biologico
- 3.2 Industriale
- 3.3 Medicinale
- 3.4 Suoli
- 3.5 Agenti addensanti
- 3.6 Cibo
- 4 Esempi di colloidi
- 5 Riferimenti
Caratteristiche dei colloidi
Composizione
Tutte le combinazioni di gas, liquido e solido possono dare origine a colloidi; tranne le miscele di gas che formano vere soluzioni. Se la miscela forma una dispersione colloidale o una sospensione, dipende dalla dimensione delle particelle, che può essere considerata analoga al soluto.
Adsorbimento
Poiché le particelle colloidali sono finemente suddivise, la conseguenza è che la loro area superficiale è molto ampia. Ciò fa sì che le particelle colloidali assorbano ioni, nonché gas, liquidi e solidi..
Elettroforesi
Le particelle colloidali sono generalmente caricate elettricamente; questo è il caso delle proteine e degli acidi nucleici. Pertanto, queste macromolecole possono muoversi in un campo elettrico, spostandosi verso l'anodo o il catodo, a seconda della loro carica elettrica..
Dialisi
Le particelle colloidali hanno un raggio che impedisce loro di passare attraverso i pori delle membrane di dialisi, consentendo loro di separarsi da altre particelle sospese più piccole. Questa funzione viene utilizzata per rimuovere le sostanze indesiderabili nelle sospensioni colloidali..
Movimento browniano
Le particelle colloidali sono dotate di moto vibratorio casuale in tutte le direzioni, cioè moto browniano. Questa caratteristica contribuisce alla non sedimentazione delle particelle e al mantenimento dell'omogeneità e stabilità delle sospensioni colloidali..
Effetto Tyndall
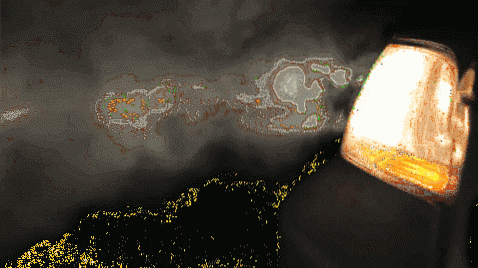
Le particelle colloidali in sospensione sono in grado di diffondere la luce in tutte le direzioni, una caratteristica che le soluzioni non presentano. Per questo motivo è possibile osservare il percorso di un fascio luminoso che passa attraverso una sospensione colloidale. Ad esempio, un raggio di luce che illumina la nebbia.
Tipi di colloidi
Emulsione
È un colloide formato dalla miscela di due liquidi immiscibili; una forma la fase dispersa e l'altra la fase disperdente. Di solito è del tipo a miscela acqua-olio.
Emulsione solida
È un tipo di colloide in cui la sua fase dispersa è un solido e la sua fase o mezzo disperdente è un liquido..
Schiuma
È un tipo di colloide in cui la fase dispersa è un gas che forma bolle, circondato dalla fase disperdente, che è un liquido..

Schiuma solida
La fase dispersa è un gas e la fase o il mezzo disperdente è un solido. Questo tipo di colloide viene prodotto nella produzione di pane e formaggio..
Soli e gel
È un sistema colloidale in cui la fase disperdente è un solido e la fase dispersa è un liquido sotto forma di grappoli. La condensazione o idrolisi del sol produce un gel che forma un materiale solido riempito di liquido..
Si dice che i gel abbiano una densità simile a quella dei liquidi, ma la loro struttura ricorda quella dei solidi.
Aerosol liquido
È un tipo di colloide in cui la fase dispersa è un liquido e la fase o il mezzo disperdente è un gas..
Spray solido
È un sistema colloidale in cui la fase dispersa è un solido e la fase o il mezzo disperdente è un gas..
Applicazioni
Biologico
I colloidi sono presenti nelle cellule degli esseri viventi. Nelle forme dei soli e dei gel costituiscono il citoplasma e il nucleo. Pertanto, la vita è considerata come un'espressione della presenza di colloidi.
Industriale
I colloidi sono utilizzati in vernici, plastica, insetticidi agricoli, inchiostri, cementi, saponi, lubrificanti, detergenti, adesivi, nonché in molti alimenti.
Le vernici sono costituite da pigmenti colloidali dispersi in solventi liquidi, in grado di formare un film solido stabile quando la vernice si asciuga.
L'inchiostro utilizzato nella stampa di giornali è costituito da carbone nero colloidale in olio. Nel frattempo, l'inchiostro nelle penne è costituito da colloidi di tipo gel..
Medicinale
Le soluzioni colloidali sono utilizzate per l'espansione del volume plasmatico in pazienti con ipovolemia postoperatoria. I colloidi d'argento sono usati come antibiotici che inattivano gli enzimi in batteri, funghi e virus. È noto che i colloidi di rame hanno attività antitumorale. Allo stesso modo, i colloidi di mercurio hanno un'azione anti-sifilitica..
I colloidi fanno parte dei meccanismi di consegna e trasporto dei farmaci, come idrogel, microemulsioni, liposomi, micelle, nanoparticelle e nanocristalli.
Suoli
I principali componenti colloidali dei suoli sono i sedimenti minerali sotto forma di argilla e humus. I colloidi del suolo svolgono un ruolo importante nello stoccaggio e nello scambio di minerali richiesti dalle piante, in particolare CaDue+, MgDue+ e K+.
Agenti addensanti
I colloidi conferiscono al mezzo desiderabili proprietà di scorrimento a dentifrici, lozioni, lubrificanti, ecc., Fornendo loro la stabilizzazione e il mantenimento delle loro fasi..
Cibo
I colloidi possono essere considerati ubiquitari negli alimenti, poiché sono presenti in quasi tutti loro. Ad esempio, l'albume è un colloide simile a un sol, costituito da molecole proteiche a catena lunga, strettamente avvolte a causa dei legami idrogeno..
Il riscaldamento dell'albume rompe i legami proteici e il sol colloide si trasforma in un idrogel.

Esempi di colloidi
Emulsione solida: formaggio, burro e gelatina.
Emulsione: latte, crema per il viso e maionese.
Schiuma: crema da barba, panna montata e schiuma di birra.
Schiuma solida: spugna, gomma e pietra pomice.
Soli: bianco d'uovo crudo, inchiostro cinese e vernice.
Gel: albume d'uovo fritto, inchiostro della penna e gelatina.

Aerosol liquido: nebbia, foschia, nuvole e rugiada.
Spray solido: fumo, materiali di scarico delle auto e particolato nell'aria.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Law J. e Brar A. (15 dicembre 2019). Colloidi. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- Wikipedia. (2020). Colloide. Estratto da: en.wikipedia.org
- Charles Clay. (30 aprile 2018). Caratteristiche di un colloide. Scienza. Estratto da: sciencing.com
- Cono A. (1995). L'uso dei colloidi nella pratica clinica. Giornale britannico di medicina ospedaliera,54(4), 155-159.
- QuimiNet. (7 febbraio 2013). Soluzioni colloidali e loro usi in medicina. Estratto da: quiminet.com


Nessun utente ha ancora commentato questo articolo.