
Storia, proprietà, struttura, rischi, usi del cloro
Il cloro È un elemento chimico rappresentato dal simbolo Cl. È il secondo degli alogeni, situato sotto il fluoro, ed è anche il terzo elemento più elettronegativo di tutti. Il suo nome deriva dal suo colore verde giallastro, più intenso del fluoruro.
Generalmente, quando qualcuno sente il tuo nome, la prima cosa a cui pensa sono i prodotti sbiancanti per i vestiti e l'acqua delle piscine. Sebbene il cloro funzioni efficacemente in questi esempi, non è il suo gas, ma i suoi composti (specialmente l'ipoclorito) che esercitano l'azione sbiancante e disinfettante..

L'immagine sopra mostra un pallone tondo con gas cloro. La sua densità è maggiore di quella dell'aria, il che spiega perché rimane nel pallone e non fuoriesce nell'atmosfera; come accade con altri gas più leggeri, per dire elio o azoto. In questo stato è una sostanza altamente tossica, poiché produce acido cloridrico nei polmoni..
Ecco perché il cloro elementare o gassoso non ha molti usi, se non in alcune sintesi. Tuttavia i suoi composti, siano essi sali o molecole organiche clorurate, coprono un buon repertorio di usi, andando oltre le piscine e gli indumenti bianchissimi..
Allo stesso modo, i suoi atomi sotto forma di anioni cloruro si trovano all'interno del nostro corpo, regolando i livelli di sodio, calcio e potassio, così come nel succo gastrico. Altrimenti, l'assunzione di cloruro di sodio sarebbe ancora più letale.
Il cloro viene prodotto per elettrolisi della salamoia, ricca di cloruro di sodio, processo industriale in cui si ottengono anche idrossido di sodio e idrogeno. E poiché i mari sono una fonte quasi inesauribile di questo sale, le potenziali riserve di questo elemento nell'idrosfera sono molto grandi..
Indice articolo
- 1 Storia
- 1.1 Primi approcci
- 1.2 Scoperta
- 1.3 Acido ossimuratico
- 1.4 Riconoscimento come elemento
- 2 Proprietà fisiche e chimiche
- 2.1 Aspetto fisico
- 2.2 Numero atomico (Z)
- 2.3 Peso atomico
- 2.4 Punto di ebollizione
- 2.5 Punto di fusione
- 2.6 Densità
- 2.7 Calore di fusione
- 2.8 Calore di vaporizzazione
- 2.9 Capacità termica molare
- 2.10 Solubilità in acqua
- 2.11 Pressione di vapore
- 2.12 Elettronegatività
- 2.13 Energie di ionizzazione
- 2.14 Conduttività termica
- 2.15 Isotopi
- 2.16 numeri di ossidazione
- 3 Struttura e configurazione elettronica
- 3.1 Molecola di cloro
- 3.2 Interazioni intermolecolari
- 4 Dove trovare e ottenere
- 4.1 Sali di cloruro
- 4.2 Elettrolisi della salamoia
- 4.3 Dissoluzione acida della pirolusite
- 5 leghe
- 6 Rischi
- 7 Usi
- 7.1 Sintesi
- 7.2 Biologici
- 7.3 Armi chimiche
- 7.4 Disinfettante
- 7.5 Candeggina
- 7.6 Cloruro di polivinile
- 8 Riferimenti
Storia
Primi approcci
A causa dell'elevata reattività del cloro gassoso, le antiche civiltà non ne sospettarono mai l'esistenza. Tuttavia, i suoi composti facevano parte della cultura dell'umanità fin dai tempi antichi; la sua storia inizia legata al sale comune.
D'altra parte, il cloro è derivato da eruzioni vulcaniche e quando qualcuno ha sciolto l'oro nell'acqua regia; Ma nessuno di questi primi approcci è stato nemmeno sufficiente per formulare l'idea che detto gas verde-giallastro fosse un elemento o un composto.
Scoperta
La scoperta del cloro è attribuita al chimico svedese Carl Wilhelm Scheele, che nel 1774 eseguì la reazione tra il minerale pirolusite e l'acido cloridrico (allora chiamato acido muriatico).
Scheele ottiene il merito di essere stato il primo scienziato a studiare le proprietà del cloro; sebbene precedentemente riconosciuto (1630) da Jan Baptist van Helmont.
Interessanti sono gli esperimenti con i quali Scheele ha ottenuto le sue osservazioni: ha valutato l'azione sbiancante del cloro sui petali rossastri e bluastri dei fiori, nonché sulle foglie di piante e insetti morti all'istante..
Allo stesso modo, ha riferito la sua elevata reattività per i metalli, il suo odore soffocante e l'effetto indesiderato sui polmoni e che quando è stato sciolto in acqua, la sua acidità è aumentata..
Acido ossimuratico
A quel punto i chimici consideravano qualsiasi composto contenente ossigeno un acido; così hanno erroneamente pensato che il cloro dovesse essere un ossido gassoso. Così lo chiamavano 'acido ossimuratico' (ossido di acido muriatico), un nome coniato dal famoso chimico francese Antoine Lavoisier.
Poi nel 1809 Joseph Louis Gay-Lussac e Louis Jacques Thénard cercarono di ridurre questo acido con il carbone; reazione con cui hanno ottenuto metalli dai loro ossidi. In questo modo, volevano estrarre l'elemento chimico del presunto acido ossimuratico (che chiamavano `` aria deflogsticata di acido muriatico ''.
Tuttavia, Gay-Lussac e Thénard fallirono nei loro esperimenti; ma avevano ragione a considerare la possibilità che detto gas verde-giallastro fosse un elemento chimico e non un composto.
Riconoscimento come elemento
Il riconoscimento del cloro come elemento chimico fu grazie a Sir Humphry Davy, che nel 1810 condusse i suoi esperimenti con elettrodi di carbonio e concluse che un simile ossido di acido muriatico non esisteva..
Inoltre, è stato Davy a coniare il nome "cloro" per questo elemento dalla parola greca "chloros", che significa verde giallastro..
Mentre studiavano le proprietà chimiche del cloro, si è scoperto che molti dei suoi composti erano di natura salina; quindi lo chiamarono "alogeno", che significa formatore di sale. Quindi il termine alogeno è stato utilizzato con gli altri elementi del suo stesso gruppo (F, Br e I).
Michael Faraday riuscì persino a liquefare il cloro in un solido che, essendo contaminato con l'acqua, formò l'idrato ClDueHDueO.
Il resto della storia del cloro è legata alle sue proprietà disinfettanti e sbiancanti, fino allo sviluppo del processo industriale di elettrolisi della salamoia per produrre enormi quantità di cloro..
Proprietà fisiche e chimiche
Aspetto fisico
È un gas denso, opaco, verde-giallastro con un odore acre irritante (una versione super potenziata del cloro commerciale) ed è anche estremamente velenoso..
Numero atomico (Z)
17
Peso atomico
35.45 u.
Salvo diversa indicazione, tutte le altre proprietà corrispondono a quantità misurate per il cloro molecolare, ClDue.
Punto di ebollizione
-34,04 ºC
Punto di fusione
-101,5 ºC
Densità
-In condizioni normali, 3,2 g / L
-Proprio al punto di ebollizione, 1,5624 g / mL
Notare che il cloro liquido è circa cinque volte più denso del suo gas. Inoltre, la densità del suo vapore è 2,49 volte maggiore di quella dell'aria. Ecco perché nella prima immagine il cloro non tende a fuoriuscire dal pallone tondo, poiché essendo più denso dell'aria si trova in basso. Questa caratteristica lo rende un gas ancora più pericoloso..
Calore di fusione
6,406 kJ / mol
Calore di vaporizzazione
20,41 kJ / mol
Capacità termica molare
33,95 J / (mol K)
Solubilità dell'acqua
1,46 g / 100 mL a 0 ºC
Pressione del vapore
7,67 atm a 25 ° C. Questa pressione è relativamente bassa rispetto ad altri gas.
Elettronegatività
3.16 della scala Pauling.
Energie di ionizzazione
-Primo: 1251,2 kJ / mol
-Secondo: 2298 kJ / mol
-Terzo: 3822 kJ / mol
Conduttività termica
8.9 10-3 W / (mK)
Isotopi
Il cloro si trova in natura principalmente come due isotopi: 35Cl, con un'abbondanza del 76%, e 37Cl, con un'abbondanza del 24%. Pertanto, il peso atomico (35,45 u) è una media delle masse atomiche di questi due isotopi, con le rispettive percentuali di abbondanza..
Tutti i radioisotopi del cloro sono artificiali, tra cui il 36Cl come il più stabile, con un'emivita di 300.000 anni.
Numeri di ossidazione
Il cloro può avere vari numeri o stati di ossidazione quando fa parte di un composto. Essendo uno degli atomi più elettronegativi nella tavola periodica, di solito ha numeri di ossidazione negativi; tranne quando incontra ossigeno o fluoro, nei cui ossidi e fluoruri, rispettivamente, deve "perdere" elettroni.
Nei loro numeri di ossidazione si ipotizza l'esistenza o la presenza di ioni con la stessa grandezza di carica. Quindi, abbiamo: -1 (Cl-, il famoso anione cloruro), +1 (Cl+), +2 (clDue+), +3 (cl3+), +4 (cl4+), +5 (cl5+), +6 (cl6+) e +7 (cl7+). Di tutti, -1, +1, +3, +5 e +7 sono i più comuni trovati nei composti clorurati..
Ad esempio, in ClF e ClF3 i numeri di ossidazione per il cloro sono +1 (Cl+F-) e +3 (cl3+F3-). Nel ClDueOppure questo è +1 (clDue+ODue-); mentre nel ClODue, ClDueO3 e ClDueO7, sono +4 (cl4+ODueDue-), +3 (clDue3+O3Due-) e +7 (clDue7+O7Due-).
In tutti i cloruri, invece, il cloro ha un numero di ossidazione -1; come nel caso di NaCl (Na+Cl-), dove è valido dire che il CI esiste- data la natura ionica di questo sale.
Struttura e configurazione elettronica
Molecola di cloro

Gli atomi di cloro nel loro stato fondamentale hanno la seguente configurazione elettronica:
[Ne] 3sDue 3p5
Pertanto, ognuno di loro ha sette elettroni di valenza. A meno che non siano sovraccarichi di energia, ci saranno singoli atomi di Cl nello spazio, come le biglie verdi. Tuttavia, la loro tendenza naturale è quella di formare legami covalenti tra di loro, al fine di completare i loro ottetti di valenza..
Si noti che difficilmente hanno bisogno di un elettrone per avere otto elettroni di valenza, quindi formano un unico semplice legame; questo è quello che unisce due atomi di Cl per creare la molecola di ClDue (immagine in alto), Cl-Cl. Ecco perché il cloro in condizioni normali e / o terrestri è un gas molecolare; non monoatomico, come con i gas nobili.
Interazioni intermolecolari
La molecola ClDue è omonucleare e apolare, quindi le sue interazioni intermolecolari sono governate dalle forze di diffusione di Londra e dalle sue masse molecolari. Nella fase gassosa, la distanza ClDue-ClDue è relativamente corto rispetto ad altri gas che sommati alla sua massa lo rendono un gas tre volte più denso dell'aria.
La luce può eccitare e promuovere transizioni elettroniche all'interno degli orbitali molecolari di ClDue; di conseguenza appare il suo caratteristico colore verde-giallastro. Questo colore si intensifica allo stato liquido e poi scompare parzialmente quando si solidifica.
Quando la temperatura scende (-34 ºC), le molecole di ClDue perdere energia cinetica e distanza ClDue-ClDue diminuisce; quindi, questi si fondono e finiscono per definire il cloro liquido. Lo stesso accade quando il sistema viene raffreddato ancora di più (-101 ºC), ora con le molecole di ClDue così vicini tra loro da definire un cristallo ortorombico.
Il fatto che esistano cristalli di cloro è indicativo che le loro forze dispersive sono sufficientemente direzionali da creare uno schema strutturale; cioè strati molecolari di ClDue. La separazione di questi strati è tale che la loro struttura non cambia nemmeno sotto una pressione di 64 GPa, né mostrano conduzione elettrica..
Dove trovare e ottenere
Sali di cloruro

Il cloro allo stato gassoso non si trova da nessuna parte sulla superficie terrestre, poiché è molto reattivo e tende a formare cloruri. Questi cloruri sono ben diffusi in tutta la crosta terrestre e, inoltre, dopo milioni di anni di essere stati spazzati via dalle piogge, stanno arricchendo i mari e gli oceani..
Di tutti i cloruri, il NaCl del minerale alite (immagine in alto) è il più comune e abbondante; seguito dai minerali silvino, KCl e carnalite, MgClDueKCl 6HDueO. Quando le masse d'acqua evaporano a causa dell'azione del Sole, lasciano laghi salati del deserto, dai quali il NaCl può essere estratto direttamente come materia prima per la produzione di cloro..
Elettrolisi della salamoia
Il NaCl si dissolve in acqua per produrre una salamoia (26%), che viene sottoposta ad elettrolisi all'interno di una cella cloro-alcalina. Lì, si verificano due semireazioni nei compartimenti dell'anodo e del catodo:
2Cl-(ac) => ClDue(g) + 2e- (Anodo)
2HDueO (l) + 2e- => 2OH-(ac) + HDue(g) (catodo)
E l'equazione globale per entrambe le reazioni è:
2NaCl (aq) + 2HDueO (l) => 2NaOH (aq) + HDue(g) + ClDue(g)
Man mano che la reazione procede, gli ioni Na+ formati all'anodo migrano nel compartimento catodico attraverso una membrana permeabile di amianto. Per questo motivo, NaOH si trova sul lato destro dell'equazione globale. Entrambi i gas, ClDue e H.Due, vengono raccolti rispettivamente dall'anodo e dal catodo.
L'immagine sotto illustra quanto appena scritto:
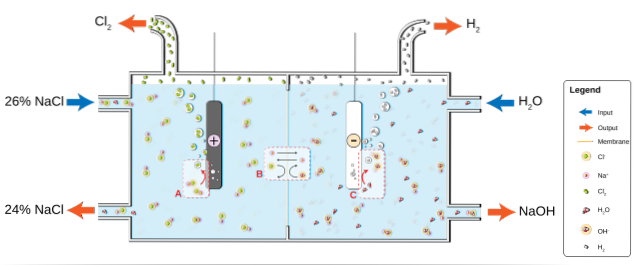
Si noti che la concentrazione della salamoia alla fine diminuisce del 2% (si passa dal 24 al 26%), il che significa che parte dei suoi anioni Cl- gli originali sono stati trasformati in molecole di ClDue. Alla fine, l'industrializzazione di questo processo ha dato un metodo per produrre cloro, idrogeno e idrossido di sodio.
Dissoluzione acida della pirolusite
Come accennato nella sezione della storia, il gas di cloro può essere prodotto sciogliendo campioni di minerali pirolusitici con acido cloridrico. La seguente equazione chimica mostra i prodotti ottenuti dalla reazione:
MnODue(s) + 4HCl (aq) => MnClDue(aq) + 2HDueO (l) + ClDue(g)
Leghe
Le leghe di cloro non esistono per due semplici motivi: le loro molecole gassose non possono essere intrappolate tra i cristalli metallici, e sono anche molto reattive, quindi reagirebbero immediatamente con i metalli per produrre i loro rispettivi cloruri..
D'altronde neppure i cloruri sono desiderabili, poiché una volta disciolti in acqua esercitano un effetto salino che favorisce la corrosione nelle leghe; e quindi, i metalli si dissolvono per formare cloruri metallici. Il processo di corrosione per ciascuna lega è diverso; alcuni sono più sensibili di altri.
Il cloro, quindi, non è affatto un buon additivo per le leghe; né come ClDue né come Cl- (e gli atomi di Cl sarebbero molto reattivi quindi possono persino esistere).
Rischi
Sebbene la solubilità del cloro in acqua sia bassa, è sufficiente produrre acido cloridrico nell'umidità della nostra pelle e degli occhi, che finisce per corrodere i tessuti provocando gravi irritazioni e persino perdita della vista..
Ancora peggio è respirare i suoi vapori giallo-verdastri, poiché una volta nei polmoni genera nuovamente acidi e danneggia il tessuto polmonare. Con questo, la persona sperimenta mal di gola, tosse e difficoltà respiratorie a causa dei fluidi formati nei polmoni.
Se c'è una perdita di cloro, ci si trova in una situazione particolarmente pericolosa: l'aria non può semplicemente "spazzare via" i suoi vapori; rimangono lì finché non reagiscono o si disperdono lentamente.
Inoltre è un composto altamente ossidante, per cui varie sostanze possono reagire in modo esplosivo con esso al minimo contatto; proprio come la lana d'acciaio e l'alluminio. Ecco perché dove è presente il cloro immagazzinato, devono essere prese tutte le considerazioni necessarie per evitare i rischi di incendio..
Ironia della sorte, mentre il gas cloro è mortale, il suo anione cloruro non è tossico; Può essere consumato (con moderazione), non brucia, né reagisce se non con fluoro e altri reagenti.
Applicazioni
Sintesi
Circa l'81% del cloro gassoso prodotto annualmente viene utilizzato per la sintesi di cloruri organici e inorganici. A seconda del grado di covalenza di questi composti, il cloro può essere trovato come semplici atomi di Cl in molecole organiche clorurate (con legami C-Cl) o come ioni Cl- in pochi sali clorurati (NaCl, CaClDue, MgClDue, eccetera.).
Ciascuno di questi composti ha le sue applicazioni. Ad esempio, cloroformio (CHCl3) e cloruro di etile (CH3CHDueCl) sono solventi che vengono utilizzati come anestetici per inalazione; diclorometano (CHDueClDue) e tetracloruro di carbonio (CCl4), nel frattempo, sono solventi ampiamente utilizzati nei laboratori di chimica organica.
Quando questi composti clorurati sono liquidi, il più delle volte vengono utilizzati come solventi per mezzi di reazione organici..
In altri composti, la presenza di atomi di cloro rappresenta un aumento del momento di dipolo, quindi possono interagire in misura maggiore con una matrice polare; uno composto da proteine, amminoacidi, acidi nucleici, ecc., biomolecole. Pertanto, il cloro ha anche un ruolo nella sintesi di farmaci, pesticidi, insetticidi, fungicidi, ecc..
Per quanto riguarda i cloruri inorganici, vengono solitamente utilizzati come catalizzatori, materia prima per ottenere metalli mediante elettrolisi o fonti di ioni Cl.-.
Biologico
Il cloro gassoso o elementare non ha alcun ruolo negli esseri viventi se non quello di distruggere i loro tessuti. Tuttavia, questo non significa che i suoi atomi non possano essere trovati nel corpo. Ad esempio, ioni Cl- sono molto abbondanti nell'ambiente cellulare ed extracellulare e aiutano a controllare i livelli di ioni Na+ e CaDue+, soprattutto.
Allo stesso modo, l'acido cloridrico fa parte del succo gastrico con cui il cibo viene digerito nello stomaco; i suoi ioni Cl-, in compagnia di H.3O+, definire il pH vicino a 1 di queste secrezioni.
Armi chimiche
La densità del cloro gassoso lo rende una sostanza mortale se versato o versato in spazi chiusi o aperti. Essendo più denso dell'aria, una sua corrente non trasporta facilmente il cloro, quindi rimane per un tempo considerevole prima di disperdersi definitivamente.
Nella prima guerra mondiale, ad esempio, questo cloro veniva usato sui campi di battaglia. Una volta rilasciato, si intrufolava nelle trincee per soffocare i soldati e costringerli a emergere..
Disinfettante

Le soluzioni clorurate, quelle in cui il cloro gassoso è stato disciolto in acqua e quindi reso alcalino con un tampone, hanno eccellenti proprietà disinfettanti, oltre a inibire la putrefazione dei tessuti. Sono stati usati per disinfettare le ferite aperte per eliminare i batteri patogeni.
L'acqua della piscina è clorata con precisione per eliminare batteri, microbi e parassiti che possono al suo interno. Il cloro gassoso veniva utilizzato per questo scopo, tuttavia la sua azione è piuttosto aggressiva. Vengono invece utilizzate soluzioni di ipoclorito di sodio (candeggina) o compresse di acido tricloroisocianurico (TCA)..
Quanto detto sopra mostra che non è il ClDue quello che esercita l'azione disinfettante ma HClO, acido ipoclorito, che produce radicali O che distruggono i microrganismi.
Candeggiare
Molto simile alla sua azione disinfettante, il cloro sbianca anche i materiali perché i coloranti responsabili dei colori sono degradati dall'HClO. Pertanto, le sue soluzioni clorurate sono ideali per rimuovere le macchie dagli indumenti bianchi o per sbiancare la pasta di carta..
Cloruro di polivinile
Il composto di cloro più importante di tutti, che rappresenta circa il 19% della produzione rimanente di cloro gassoso, è il cloruro di polivinile (PVC). Questa plastica ha molteplici usi. Con esso vengono realizzati tubi dell'acqua, infissi, rivestimenti per pareti e pavimenti, cavi elettrici, sacche per flebo, cappotti, ecc..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Cloro. Estratto da: en.wikipedia.org
- Laura H. et al. (2018). Struttura del cloro solido a 1,45 GPaZeitschrift für Kristallographie. Materiali cristallini, volume 234, numero 4, pagine 277-280, ISSN (online) 2196-7105, ISSN (stampa) 2194-4946, DOI: doi.org/10.1515/zkri-2018-2145
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Cloro. Database PubChem. CID = 24526. Estratto da: pubchem.ncbi.nlm.nih.gov
- Marques Miguel. (s.f.). Cloro. Estratto da: nautilus.fis.uc.pt
- Consiglio americano di chimica. (2019). Chimica del cloro: introduzione al cloro. Estratto da: chlorine.americanchemistry.com
- Fong-Yuan Ma. (S.f.). Effetti corrosivi dei cloruri sui metalli. Dipartimento di ingegneria navale, Repubblica cinese NTOU (Taiwan).
- Stato di New York. (2019). I fatti sul cloro. Estratto da: health.ny.gov
- Dr. Doug Stewart. (2019). Fatti dell'elemento del cloro. Chemicool. Estratto da: chemicool.com



Nessun utente ha ancora commentato questo articolo.